Hidrogenul
Hidrogenul are trei izotopi principali: protiul (1H), deuteriul (2H) și tritiul (3H). Acești izotopi se formează în mod natural în natură. Protiul și deuteriul sunt stabili. Tritiul este radioactiv și are un timp de înjumătățire de aproximativ 12 ani. Oamenii de știință au creat alți patru izotopi de hidrogen (4H la7 H), dar acești izotopi sunt foarte instabili și nu există în natură.
Principalii izotopi ai hidrogenului sunt unici, deoarece sunt singurii izotopi care au un nume. Aceste denumiri sunt folosite și în prezent. Deuteriul și tritiul primesc uneori propriile lor simboluri, D și T. Cu toate acestea, Uniunea Internațională de Chimie Pură și Aplicată nu apreciază prea mult aceste denumiri, deși sunt folosite adesea. Există și alți izotopi care au avut nume proprii atunci când oamenii de știință au studiat radioactivitatea. Dar, numele lor nu mai sunt folosite astăzi.
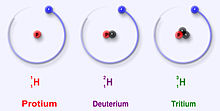
Cei mai stabili trei izotopi ai hidrogenului
Protium (hidrogen-1)
Protiul este cel mai comun izotop al hidrogenului. Acesta reprezintă mai mult de 99,98% din tot hidrogenul din univers. Se numește protium deoarece nucleul său are doar un singur proton. Protiul are o masă atomică de 1,00782504(7) u. Simbolul protiului este 1H.Protonul protiului nu s-a dezintegrat niciodată în urma unei observații, astfel încât oamenii de știință cred că protiul este un izotop stabil. Noile teorii ale fizicii particulelor prevăd că un proton se poate dezintegra, dar această dezintegrare este foarte lentă. Se spune că protonul are un timp de înjumătățire de 1036 ani. Dacă dezintegrarea protonului este adevărată, atunci toate celelalte nuclee despre care se spune că sunt stabile sunt, de fapt, stabile doar din punct de vedere observațional, adică par a fi stabile. Experimentele recente au arătat că, în cazul în care se produce dezintegrarea protonului, acesta ar avea un timp de înjumătățire de 6,6 × 1033 ani.
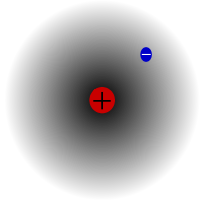
Protiul, cel mai frecvent izotop al hidrogenului. Este special, deoarece este singurul izotop care nu are neutroni.
Deuteriu (hidrogen-2)
Deuteriul, sau 2H sau uneori D, este un alt izotop stabil al hidrogenului. Acest izotop are un proton și un neutron. Reprezintă aproximativ 0,0026 - 0,0184% din toți atomii de hidrogen de pe Pământ. Deuteriul este mai puțin prezent în hidrogenul gazos de pe Pământ și mai mult în apa de mare (0,015% sau 150 ppm). Deuteriul nu este radioactiv și nu dăunează organismelor vii. Deuteriul poate, de asemenea, să formeze molecule de apă. Apa care are deuteriu în loc de protium se numește apă grea.
Tritiu (hidrogen-3)
Tritiul (3H) este cel mai stabil radioizotop al hidrogenului. Altfel spus, dintre toți izotopii radioactivi ai hidrogenului, tritiul este cel mai puțin radioactiv. Acesta are un proton și 2 neutroni în nucleu. Tritiul se dezintegrează prin dezintegrare beta minus și se transformă în heliu-3. Acesta are un timp de înjumătățire de 12,32 ani.Tritiul se formează în mod natural prin interacțiunea dintre gazele din atmosfera superioară și razele cosmice. De asemenea, este creat în timpul testelor cu arme nucleare. Tritiul și deuteriul sunt utilizate în fuziunea nucleară D-T din stele pentru a produce multă energie.
Întrebări și răspunsuri
Î: Câți izotopi principali ai hidrogenului există?
R: Există trei izotopi principali ai hidrogenului: protiul, deuteriul și tritiul.
Î: Protiul și deuteriul sunt izotopi stabili?
R: Da, protiul și deuteriul sunt izotopi stabili.
Î: Care este timpul de înjumătățire al tritiului?
R: Tritiul este radioactiv și are un timp de înjumătățire de aproximativ 12 ani.
Î: Câți alți izotopi de hidrogen au mai fost creați de oamenii de știință?
R: Oamenii de știință au creat alți patru izotopi de hidrogen: de la 4H la 7H.
Î: Există acești patru izotopi de hidrogen suplimentari în mod natural?
R: Nu, acești izotopi sunt foarte instabili și nu există în mod natural.
Î: Ce face ca principalii izotopi de hidrogen să fie unici?
R: Principalii izotopi ai hidrogenului sunt unici, deoarece sunt singurii izotopi care au un nume.
Î: Au deuteriul și tritiul simboluri proprii?
R: Da, deuteriul și tritiul au uneori propriile simboluri: D și T. Cu toate acestea, Uniunea Internațională de Chimie Pură și Aplicată nu apreciază prea mult aceste denumiri, chiar dacă ele sunt folosite adesea.
Căuta în