Stare de tranziție
Într-o reacție chimică, starea de tranziție este punctul în care există o valoare maximă a energiei. Această energie se numește energie de activare. Atunci când două sau mai multe molecule sunt amestecate, acestea se vor lovi reciproc. Dacă acestea se lovesc cu suficientă energie pentru a trece prin starea de tranziție, vor reacționa și vor forma noi molecule. În starea de tranziție, se formează noi legături, în timp ce legăturile vechi sunt rupte. Într-un grafic sau într-un desen, starea de tranziție este deseori marcată cu simbolul ‡, un pumnal dublu.
Este foarte dificil de studiat o stare de tranziție. Acest lucru se datorează faptului că are o energie atât de mare încât moleculele vor rămâne în această formă pentru un timp foarte scurt, de obicei femtosecunde. Este important să nu confundați stările de tranziție cu intermediarii. Intermediarii se găsesc la punctele minime de energie și pot trăi foarte mult timp. Totuși, la fel ca o stare de tranziție, un intermediar se află între reactivii și produsele unei reacții.
Studierea stărilor de tranziție este foarte importantă pentru a înțelege mecanismele de reacție. Există teorii și programe de calculator care pot fi folosite pentru a calcula cum arată starea de tranziție. Aceasta este o parte a cineticii chimice.
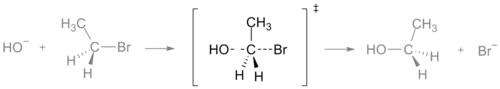
Starea de tranziție a unei reacții SN2
Întrebări și răspunsuri
Î: Ce este starea de tranziție într-o reacție chimică?
R: Starea de tranziție este punctul în care există o valoare maximă a energiei într-o reacție chimică.
Î: Ce este energia de activare într-o reacție chimică?
R: Energia necesară pentru ca o reacție să aibă loc se numește energie de activare.
Î: Ce se întâmplă atunci când două sau mai multe molecule sunt amestecate într-o reacție chimică?
R: Atunci când două sau mai multe molecule sunt amestecate, ele se vor lovi una de cealaltă. Dacă se lovesc cu suficientă energie pentru a trece prin starea de tranziție, ele vor reacționa și vor forma noi molecule.
Î: Pentru ce se folosește simbolul pumnalului dublu (‡) într-un grafic sau desen al unei reacții chimice?
R: Simbolul pumnalului dublu (‡) este utilizat pentru a marca starea de tranziție într-un grafic sau desen al unei reacții chimice.
Î: De ce este dificil de studiat starea de tranziție într-o reacție chimică?
R: Este foarte dificil de studiat starea de tranziție într-o reacție chimică deoarece aceasta are o energie atât de mare încât moleculele vor rămâne în acea formă pentru un timp foarte scurt, de obicei femtosecunde.
Î: Ce este un intermediar într-o reacție chimică?
R: Un intermediar este o moleculă care se găsește în punctele minime de energie într-o reacție chimică și care poate trăi foarte mult timp.
Î: De ce este importantă studierea stărilor de tranziție în înțelegerea mecanismelor de reacție?
R: Studierea stărilor de tranziție este importantă pentru înțelegerea mecanismelor de reacție, deoarece ajută la determinarea modului în care are loc o reacție și a modului în care aceasta poate fi controlată sau manipulată.
Căuta în