Reacțiile cheletropice | tip de reacție periciclică
O reacție cheletropică este un tip de reacție periciclică în care un atom de pe unul dintre reactivi primește două legături noi. O reacție periciclică este o reacție care implică o stare de tranziție cu o matrice ciclică de atomi și o matrice ciclică asociată de orbitali care interacționează. În această matrice ciclică are loc o reorganizare a legăturilor σ și π.
Reacțiile cheletrope sunt o subclasă de cicloadiții. Ceea ce diferențiază reacțiile cheletrope este faptul că, la unul dintre reactivi, ambele legături noi se realizează la același atom. Câteva exemple sunt prezentate în dreapta în figura 1. În primul caz, atomul unic este atomul de carbon din grupul carbonil. Acel atom de carbon sfârșește în monoxid de carbon. Rezultatul final este realizarea a două noi legături cu un singur atom. Primele două exemple sunt cunoscute sub numele de "extruziuni cheletrope", deoarece în urma reacției se degajă o mică moleculă stabilă. Forța motrice a acestor reacții este adesea avantajul entropic al eliberării unui gaz (de exemplu, CO sau N2 ).

Figura 1. Reacții periciclice
Analiza teoretică
Datorită geometriei moleculelor implicate în reacțiile cheletrope, acestea confirmă o serie de predicții făcute de chimiștii teoreticieni. Reacțiile cheletrope confirmă conservarea simetriei orbitalilor moleculari.
În starea de tranziție periciclică, o moleculă mică donează doi electroni inelului. Reacția poate fi explicată prin două geometrii posibile. Molecula mică se poate apropia în mod liniar sau neliniar. În abordarea liniară, electronii din orbitalul moleculei mici sunt îndreptați direct spre sistemul π al moleculei mari. În abordarea neliniară, orbitalul se apropie la un unghi ușor deplasat. Capacitatea sistemelor π de a se roti pe măsură ce molecula mică se apropie este crucială în formarea de noi legături. Direcția de rotație va fi diferită în funcție de câți electroni π se află în sistem. O diagramă a unui fragment cu doi electroni care se apropie de un sistem π cu patru electroni folosind orbitali moleculari de frontieră este prezentată mai jos. Rotația va fi disrotatorie dacă mica moleculă se apropie liniar și conrotatorie dacă molecula se apropie neliniar. Disrotația și conrotația indică modul în care se rotesc legăturile din sistemul π. Disrotația înseamnă direcții opuse, în timp ce conrotația înseamnă aceeași direcție. Acest lucru este prezentat și în diagrama de mai jos.
Folosind regula lui Huckel, se poate spune dacă sistemul π este aromatic sau antiaromatic. Dacă este aromatic, abordările liniare folosesc mișcarea de disrotație, în timp ce abordările neliniare folosesc mișcarea de conotație. Opusul este valabil în cazul unui sistem antiaromatic. Abordările liniare vor avea o mișcare conrotatorie, în timp ce abordările neliniare vor avea o mișcare disrotatorie.
Reacții cheletrope în care intervine SO2
Termodinamică
Atunci când dioxidul de sulf reacționează cu butadiena și izoprenul, rezultă două produse diferite. Mecanismul de reacție va controla ceea ce se obține. Sunt posibile atât un produs cinetic, cât și un produs termodinamic. Produsul termodinamic se obține mai mult decât produsul cinetic. Produsul cinetic provine dintr-o reacție Diels-Alder, în timp ce o reacție cheletropică produce un produs mai stabil din punct de vedere termodinamic. Calea cheletropică este utilizată mai mult pentru că produce un produs de adaos mai stabil cu cinci cicluri cu cinci membri. Schema de mai jos arată diferența dintre cei doi produși. Calea din stânga arată produsul termodinamic, în timp ce calea din dreapta arată produsul cinetic. Suarez și Sordo au demonstrat acest lucru în 1995. Ei au demonstrat acest lucru atât prin experimente, cât și prin calcule Gaussian.
Cinetică
Un exemplu în acest sens îl constituie reacțiile cheletrope ale 1,3-dienilor cu dioxidul de sulf. Chimiștii au analizat cu atenție cinetica acestei reacții. În 1976, Isaacs și Laila au măsurat factorii cinetici pentru adiția dioxidului de sulf la derivații butadienei. Vitezele de adiție au fost monitorizate în benzen la 30 °C cu un exces inițial de douăzeci de ori mai mare de dienă. Ei au folosit un spectrofotometru pentru a studia lumina la 320 nm pentru a măsura dispariția SO2 . Reacția a prezentat o "cinetică de pseudo-ordine întâi". Chimiștii au descoperit că grupările de retragere a electronilor de pe dienă au scăzut viteza de reacție. De asemenea, viteza de reacție a fost afectată considerabil de efectele sterice ale substituenților 2, grupurile mai voluminoase crescând viteza de reacție. (Cu alte cuvinte, cu cât grupul de atomi mai mare atârnat de al doilea atom de carbon era mai mare, cu atât reacția se desfășura mai rapid). Autorii atribuie acest lucru tendinței grupurilor voluminoase de a favoriza conformația cisoidă a dienei, care este esențială pentru reacție (a se vedea tabelul de mai jos). În plus, au fost măsurate vitezele la patru temperaturi pentru șapte dintre diene. Pe baza acestor măsurători, chimiștii au folosit ecuația Arrhenius pentru a calcula entalpia de activare (ΔH‡ ) și entropia de activare (ΔS‡ ) pentru fiecare reacție. Acesta a fost unul dintre primele eforturi importante de a studia cinetica unei reacții cheletrope.
| -Butadienă | 104 k /min−1 (30 °C) (± 1-2%) absolut | 104 k /min−1 (30 °C) (± 1-2%) relativ | ΔH‡ /kcal mol−1 | ΔS‡ /cal mol−1 K−1 |
| 2-metil | 1.83 | 1.00 | 14.9 | -15 |
| 2-etil | 4.76 | 2.60 | 10.6 | -20 |
| 2-izopropil | 13.0 | 7.38 | 12.5 | -17 |
| 2-terț-butil | 38.2 | 20.8 | 10.0 | -19 |
| 2-neopentil | 17.2 | 9.4 | 11.6 | -18 |
| 2-cloro | 0.24 | 0.13 | N/A | N/A |
| 2-bromoetil | 0.72 | 0.39 | N/A | N/A |
| 2-p-tolil | 24.7 | 13.5 | 10.4 | -19 |
| 2-fenil | 17.3 | 9.45 | N/A | N/A |
| 2-(p-bromofenil) | 9.07 | 4.96 | N/A | N/A |
| 2,3-dimetil | 3.54 | 1.93 | 12.3 | -18 |
| cis-1-metil | 0.18 | 0.10 | N/A | N/A |
| trans-1-metil | 0.69 | 0.38 | N/A | N/A |
| 1,2-dimetilen-ciclohexan | 24.7 | 13.5 | 11.4 | -16 |
| 2-metil-1,1,1,4,4-d4 | 1.96 | N/A | N/A | N/A |
Monnat, Vogel și Sordo, în 2002, au măsurat cinetica de adiție a dioxidului de sulf la 1,2-dimetilidencicloalcani. Aceștia au scris că reacția 1,2-dimetilidenciclohexanului cu dioxidul de sulf poate da doi produși diferiți în funcție de condițiile de reacție. Reacția produce sultina corespunzătoare printr-o reacție hetero-Diels-Alder sub control cinetic (≤ -60 °C), dar, sub control termodinamic (≥ -40 °C), reacția produce sulfolena corespunzătoare printr-o reacție cheletropică. Entalpia de activare pentru reacția hetero-Diels-Alder este cu aproximativ 2 kcal/mol mai mică decât cea pentru reacția cheletropică corespunzătoare. Sulfolena este cu aproximativ 10 kcal/mol mai stabilă decât sultina izometrică în soluție CH2 Cl2 /SO .2
Autorii au reușit să elaboreze experimental o lege de viteză la 261,2 K pentru reacția 1,2-dimetilideneciclohexanului cu dioxidul de sulf pentru a obține sulfolenul corespunzător. Reacția a fost de ordinul întâi în cazul 1,2-dimetilidenciclohexanului, dar de ordinul doi în cazul dioxidului de sulf (a se vedea mai jos). Acest lucru a confirmat o predicție a chimiștilor teoreticieni bazată pe calcule cuantice ab initio de nivel înalt. Utilizând metode de calcul, autorii au propus o structură de tranziție pentru reacția cheletropică a 1,2-dimetilidenciclohexanului cu dioxidul de sulf (a se vedea figura din dreapta). Reacția este de ordinul al doilea în cazul dioxidului de sulf, deoarece o altă moleculă de dioxid de sulf se leagă probabil de starea de tranziție pentru a contribui la stabilizarea acesteia. Rezultate similare au fost găsite într-un studiu realizat în 1995 de Suarez, Sordo și Sordo, care au folosit calcule ab initio pentru a studia controlul cinetic și termodinamic al reacției dioxidului de sulf cu 1,3-diene.
Efectele solvenților
Efectul solventului asupra reacției cheletropice a 3,4-dimetil-2,5-dihidrotiofen-1,1-dioxid (prezentat în dreapta) a fost investigat cinetic în 14 solvenți. S-a constatat că constantele vitezei de reacție a reacției directe și inverse, precum și constantele de echilibru, sunt corelate liniar cu scara de polaritate a solventului ET (30).
Reacțiile au fost efectuate la 120 °C și au fost studiate prin spectroscopia 1H-NMR a amestecului de reacție. S-a constatat că viteza de reacție k1 scade cu un factor de 4,5 în cazul trecerii de la ciclohexan la metanol. S-a constatat că viteza inversă k-1 a crescut cu un factor de 53 de la ciclohexan la metanol, în timp ce constanta de echilibru Keq a scăzut cu un factor de 140. Se sugerează că există o schimbare a polarității în timpul procesului de activare, după cum reiese din relațiile dintre datele de echilibru și cele cinetice. Autorii spun că reacția pare să fie influențată de polaritatea solventului, iar acest lucru poate fi demonstrat prin schimbarea momentelor dipolare la trecerea de la reactant la starea de tranziție la produs. Autorii afirmă, de asemenea, că reacția cheletropică nu pare să fie influențată nici de aciditatea, nici de bazicitatea solventului.
Rezultatele acestui studiu îi determină pe autori să se aștepte la următoarele comportamente:
1. Schimbarea polarității solventului va influența viteza mai puțin decât echilibrul.
2. Constantele de viteză vor fi caracterizate de efectul opus al polarității: k1 va scădea ușor odată cu creșterea lui ET (30), iar k-1 va crește în aceleași condiții.
3. Efectul asupra k-1 va fi mai mare decât asupra k1 .
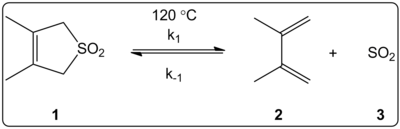
Reacția cheletrotropică studiată în diverși solvenți

Stare de tranziție propusă pentru reacția 1,2-dimetilideneciclohexanului cu SO2 pentru a da o sulfolenă printr-o reacție cheletropă

Reacția 1,2-Dimetilideneciclohexanului cu SO2 dă o sultină printr-o reacție Hetero-Diels-Alder sub control cinetic sau o sulfolenă printr-o reacție cheletropă sub control termodinamic
Adaosuri carbene la alchene
Una dintre cele mai importante reacții cheletropice din punct de vedere sintetic este adiția unui carben singlet la o alchenă pentru a obține un ciclopropan (a se vedea figura din stânga). Un carben este o moleculă neutră care conține un carbon divalent cu șase electroni în învelișul de valență. Din acest motiv, carbenele sunt electrofile foarte reactive și sunt generate ca intermediari de reacție. Un carben singlet conține un orbital p gol și un orbital hibrid aproximativ sp2 care are doi electroni. Carbenele singlet se adaugă stereospecific la alchene, iar stereochimia alchenei se păstrează în produsul ciclopropan. Mecanismul de adiție a unui carben la o alchenă este o cicloadiție concertată [2+1] (a se vedea figura). Carbenii derivați din cloroform sau bromoform pot fi utilizați pentru a adăuga CX2 la o alchenă pentru a obține un dihalociclopropan, în timp ce reactivul Simmons-Smith adaugă CH2 .
Interacțiunea orbitalului umplut al carbenei cu sistemul π alchenic creează un sistem cu patru electroni și favorizează o abordare neliniară. Este, de asemenea, favorabilă amestecarea orbitalului p gol al carbenei cu orbitalul π umplut al alchenei. Amestecul favorabil are loc printr-o abordare neliniară (a se vedea figura 2 din dreapta). Cu toate acestea, în timp ce teoria favorizează în mod clar o abordare neliniară, nu există implicații experimentale evidente pentru o abordare liniară vs. neliniară.

Figura 2. A) Orbitalii pentru carbeni singulari B) Abordarea neliniară a) a) a orbitalului sp2 al carbonului și b) a orbitalului p al carbonului

Adăugarea unei carbene la o alcană pentru a forma un ciclopropan
Întrebări și răspunsuri
Î: Ce este o reacție cheletropică?
R: O reacție cheletropică este un tip de reacție periciclică în care un atom de pe unul dintre reactivi primește două legături noi.
Î: Ce este o reacție periciclică?
R: O reacție periciclică este o reacție care implică o stare de tranziție cu o matrice ciclică de atomi și o matrice ciclică asociată de orbitali care interacționează, în care are loc o reorganizare a legăturilor َ și ً.
Î: Prin ce se deosebește de alte tipuri de reacții?
R: Reacțiile cheletrope sunt o subclasă de cicloadiții, iar ceea ce le diferențiază de alte tipuri de reacții este faptul că, la unul dintre reactivi, ambele legături noi se realizează la același atom.
Î: Care sunt câteva exemple?
R: Printre exemple se numără "extrudările cheletrope", cum ar fi atunci când atomul unic din grupa carbonil ajunge în monoxid de carbon.
Î: Ce determină aceste reacții?
R: Forța motrice a acestor reacții este adesea avantajul entropic al eliberării unui gaz (de exemplu, CO sau N2).
Î: Figura 1 este legată de reacțiile cheletrope? R: Da, figura 1 prezintă exemple de reacții cheletrope.
Căuta în
![{\displaystyle {\frac {d[3]}{dt}}=k_{2}[1][SO_{2}]^{2}}](https://www.alegsaonline.com/image/a02f69dd0783356fbf24499f57d0df29cd264f16.svg)