Atom | cea mai elementară unitate de bază a materiei
Un atom este cea mai elementară unitate de bază a materiei. Toată materia normală de pe Pământ și de pretutindeni din Univers este formată din atomi. Aceasta include solidele, lichidele și gazele. Există un număr fix de tipuri diferite de atomi, numite elemente chimice. Un atom este cea mai mică unitate de materie care se poate combina cu alți atomi pentru a forma molecule și materie mai complexă care are calități chimice specifice.
Atomii sunt foarte mici, dar dimensiunea lor exactă depinde de tipul lor. Atomii au un diametru cuprins între 0,1 și 0,5 nanometri. Un nanometru este de aproximativ 100.000 de ori mai mic decât lățimea unui fir de păr uman. Acest lucru face ca un atom să fie imposibil de văzut fără instrumente speciale. Oamenii de știință descoperă modul în care funcționează atomii făcând experimente.
Atomii sunt compuși din trei tipuri de particule subatomice. Acestea sunt protoni, neutroni și electroni. Protonii și neutronii sunt mai grei și se află în mijlocul atomului, care se numește nucleu. Nucleul este foarte mic și dens. Acesta este înconjurat de electroni cu greutate redusă. Electronii sunt atrași de nucleu prin forța electromagnetică, deoarece au sarcini electrice opuse.
Atomii cu același număr de protoni sunt același element chimic. Aceștia au proprietăți foarte asemănătoare. Exemple de elemente sunt hidrogenul și aurul. În lumea naturală există aproximativ 92 de elemente. (Mai multe au fost fabricate artificial în laborator). Atomii cu același număr de protoni, dar cu număr diferit de neutroni, se numesc izotopi. De obicei, un atom are același număr de electroni ca și protoni. Dacă un atom are mai mulți sau mai puțini electroni decât protoni, se numește ion și are sarcină electrică.
Multe lucruri sunt alcătuite din mai multe tipuri de atomi. Acestea sunt compuși sau amestecuri chimice. Atomii se pot uni prin legături chimice. Un grup de atomi conectați prin legături chimice se numește moleculă. De exemplu, o moleculă de apă este formată din doi atomi de hidrogen și un atom de oxigen.
Atomii sunt doar rareori creați, distruși sau transformați într-un alt tip de atom. Acest lucru se întâmplă în cazul în care forțele din interiorul lor sunt prea slabe pentru a-i ține împreună. Aceste schimbări sunt studiate în fizica nucleară. De asemenea, atomii se pot uni pentru a forma atomi mai mari la temperaturi foarte ridicate, cum ar fi în interiorul unei stele.
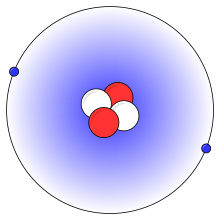
O imagine simplificată a unui atom de heliu, cu doi protoni (roșu), doi neutroni (alb) și doi electroni (albastru).
Istoric
Cuvântul "atom" provine din grecescul (ἀτόμος) "atomos", indivizibil, de la (ἀ)-, nu, și τόμος, o tăietură. Prima persoană despre care știm că a folosit cuvântul "atom" este filosoful grec Democritus, în jurul anului 400 î.Hr. El credea că totul este alcătuit din atomi, iar atomii nu pot fi rupți în bucăți mai mici. Teoria atomică a fost inițial un subiect filosofic, fără prea multe investigații sau studii științifice reale, până la dezvoltarea chimiei în anii 1650.
În 1777, chimistul francez Antoine Lavoisier a definit pentru prima dată termenul de element. El a spus că un element este orice substanță de bază care nu poate fi descompusă în alte substanțe prin metode chimice. Orice substanță care putea fi descompusă era un compus.
În 1803, filozoful englez John Dalton a sugerat că elementele sunt alcătuite din bile mici și solide numite atomi. Dalton credea că toți atomii aceluiași element au aceeași masă. El a spus că se formează compuși atunci când atomii mai multor elemente se combină. Potrivit lui Dalton, într-un anumit compus, atomii elementelor din compus se combină întotdeauna în același mod.
În 1827, omul de știință britanic Robert Brown a analizat la microscop boabele de polen din apă. Boabele de polen păreau să se agite. Brown a folosit teoria atomică a lui Dalton pentru a descrie modelele în modul în care se mișcau. Acest lucru a fost numit mișcarea browniană. În 1905, Albert Einstein a folosit matematica pentru a dovedi că particulele de polen erau mișcate de mișcarea sau căldura moleculelor individuale de apă. În acest fel, el a demonstrat în mod concludent existența atomului. În 1869, omul de știință rus Dmitri Mendeleev a publicat prima versiune a tabelului periodic. Tabelul periodic grupează elementele în funcție de numărul lor atomic (numărul de protoni pe care îl au; de obicei, acesta este același cu numărul de electroni). Elementele din aceeași coloană, sau perioadă, au de obicei proprietăți similare. De exemplu, heliul, neonul, arginul, kriptonul și xenonul se află în aceeași coloană și au proprietăți foarte asemănătoare. Toate aceste elemente sunt gaze care nu au culoare sau miros. De asemenea, ele nu se pot combina cu alți atomi pentru a forma compuși. Împreună sunt cunoscute sub numele de gaze nobile.
Fizicianul J.J. Thomson a fost prima persoană care a descoperit electronii. Acest lucru s-a întâmplat în timp ce lucra cu raze catodice în 1897. El și-a dat seama că aceștia aveau o sarcină negativă, iar nucleul atomic avea o sarcină pozitivă. Thomson a creat modelul budincii de prune, care spunea că un atom este ca o budincă de prune: fructele uscate (electronii) erau prinse într-o masă de budincă (având o sarcină pozitivă). În 1909, un om de știință pe nume Ernest Rutherford a folosit experimentul Geiger-Marsden pentru a demonstra că cea mai mare parte a unui atom se află într-un spațiu foarte mic, nucleul atomic. Rutherford a luat o placă foto și a acoperit-o cu o folie de aur. Apoi a tras asupra ei particule alfa (formate din doi protoni și doi neutroni lipiți împreună). Multe dintre particule au trecut prin folia de aur, ceea ce a demonstrat că atomii sunt în mare parte spațiu gol. Electronii sunt atât de mici și se mișcă atât de repede încât nu au împiedicat particulele să treacă. Rutherford a descoperit ulterior protoni în nucleu.
În 1913, Niels Bohr a introdus modelul Bohr. Acest model arăta că electronii se deplasează în jurul nucleului pe orbite circulare fixe. Acesta era mai precis decât modelul Rutherford. Cu toate acestea, încă nu era complet corect. După introducerea modelului Bohr, au fost aduse îmbunătățiri la modelul Bohr.
În 1925, chimistul Frederick Soddy a descoperit că unele elemente din tabelul periodic au mai multe tipuri de atomi, numiți izotopi. Soddy credea că izotopii unui element au mase diferite. Pentru a demonstra acest lucru, chimistul Francis W. Aston a construit spectrometrul de masă, care măsoară masa atomilor individuali. Aston a demonstrat că Soddy avea dreptate. De asemenea, a descoperit că masa fiecărui atom este de un număr întreg de ori mai mare decât masa protonului. Acest lucru însemna că în nucleu trebuie să existe și alte particule în afară de protoni. În 1932, fizicianul James Chadwick a injectat particule alfa în atomii de beriliu. El a văzut că o particulă a ieșit din atomii de beriliu. Această particulă nu avea sarcină, dar avea aproximativ aceeași masă ca un proton. El a numit această particulă neutron.
Cel mai precis model de până acum provine din ecuația lui Schrödinger. Schrödinger a aflat că electronii există într-un nor în jurul nucleului, numit nor electronic. În norul de electroni, este imposibil de știut cu exactitate unde se află electronii. Ecuația lui Schrödinger este utilizată pentru a determina unde este posibil să se afle un electron. Această zonă se numește orbitalul electronului.
În 1937, chimistul german Otto Hahn a fost primul care a realizat fisiunea nucleară în laborator. El a descoperit acest lucru din întâmplare când a tras neutroni asupra unui atom de uraniu, în speranța de a obține un nou izotop. Cu toate acestea, a observat că, în loc de un nou izotop, uraniul s-a transformat într-un atom de bariu, un atom mai mic decât uraniul. Hahn "rupsese" atomul de uraniu. Aceasta a fost prima reacție de fisiune nucleară înregistrată în lume. Această descoperire a dus în cele din urmă la crearea bombei atomice și a energiei nucleare, unde fisiunea are loc în mod repetat, creând o reacție în lanț.
Mai departe, în secolul XX, fizicienii au aprofundat misterele atomului. Cu ajutorul acceleratoarelor de particule, au descoperit că protonii și neutronii erau făcuți din alte particule, numite quarci.
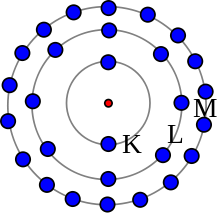
Modelul Bohr nu este precis, dar este util pentru ideea de învelișuri de electroni. Acest atom are 28 de electroni în trei învelișuri.
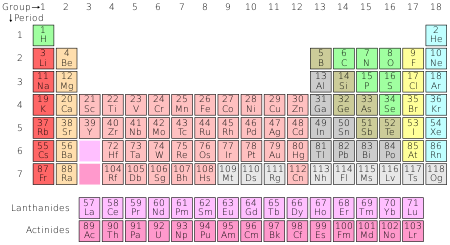
Tabelul periodic organizează toate elementele chimice cunoscute.

Ernest Rutherford
Clasificare
Numărul de protoni dintr-un atom se numește număr atomic. Atomii aceluiași element au același număr atomic. De exemplu, toți atomii de carbon au șase protoni, deci numărul atomic al carbonului este șase. În prezent, se cunosc 118 elemente. În funcție de modul în care este numărat numărul, pe Pământ există în mod natural între 90 și 94 de elemente. Toate elementele de peste numărul 94 au fost create doar de către oameni. Aceste elemente sunt organizate în tabelul periodic.
Deoarece protonii și neutronii au o masă foarte asemănătoare, iar masa electronilor este foarte mică, putem numi numărul de protoni și neutroni dintr-un atom numărul său de masă. Majoritatea elementelor au mai mulți izotopi cu numere de masă diferite. Pentru a numi un izotop, folosim numele elementului, urmat de numărul său de masă. Astfel, un atom cu șase protoni și șapte neutroni se numește carbon-13. Masa medie a tuturor atomilor unui anumit element se numește masă atomică sau greutate atomică.
Dacă protonii, neutronii sau electronii unui atom sunt înlocuiți cu alte particule, se pot obține atomi exotici. Experimentele au arătat că fiecare particulă are un opus numit antiparticulă. Împreună, aceste particule alcătuiesc antimateria. Un atom de antimaterie ar fi alcătuit din antiprotoni, antineutroni și antielectroni (pozitroni). Atunci când o particulă întâlnește antiparticula sa, ambele sunt distruse. În afară de aceasta, atomii de antimaterie ar putea fi foarte asemănători cu atomii normali.
Structură și părți
Piese
Un atom este alcătuit din trei particule principale: protonul, neutronul și electronul. Hidrogenul-1, un izotop al hidrogenului, nu are neutroni, ci doar un proton și un electron. Un ion pozitiv de hidrogen nu are electroni, ci doar un proton. Toți ceilalți atomi au cel puțin un proton, un neutron și un electron fiecare.
Electronii sunt de departe cele mai mici dintre cele trei particule atomice. Dimensiunea lor este prea mică pentru a fi măsurată cu ajutorul tehnologiei actuale, iar masa lor este de aproximativ 9,1×10−28 grame (0,00055 unități de masă atomică). Ei au o sarcină negativă. Protonii și neutronii au dimensiuni și greutate similare, cu o masă de aproximativ 1,7×10−24 grame (1 unitate de masă atomică). Protonii au o sarcină pozitivă, iar neutronii nu au nicio sarcină. Majoritatea atomilor au o sarcină neutră. Numărul de protoni (pozitivi) și de electroni (negativi) este același, astfel încât sarcinile se echilibrează la zero. Cu toate acestea, în cazul ionilor (număr diferit de electroni), acest lucru nu este valabil și aceștia pot avea o sarcină pozitivă sau negativă. Protonii și neutronii sunt compuși din quarci de două tipuri: quarci up și quarci down. Un proton este alcătuit din doi quarci up și un quarc down, iar un neutron este alcătuit din doi quarci down și un quarc up.
Nucleu
Nucleul se află în mijlocul unui atom. Acesta reprezintă mai mult de 99,9% din masa atomului. Cu toate acestea, este foarte mic: aproximativ 1 femtometru (10−15 m) în diametru, ceea ce este de aproximativ 100.000 de ori mai mic decât lățimea unui atom, deci are o densitate foarte mare. Este alcătuit din protoni și neutroni. De obicei, în natură, două lucruri cu aceeași sarcină se resping sau se îndepărtează unul de celălalt. Așadar, pentru o lungă perioadă de timp, oamenii de știință nu au știut cum protonii încărcați pozitiv din nucleu au rămas împreună. În prezent, credem că atracția dintre protoni și neutroni provine din interacțiunea puternică.
Interacțiunea puternică este cea mai puternică pe o distanță foarte scurtă. La această distanță, ea este purtată de o particulă numită gluon. Gluonii acționează ca un lipici pentru a lipi quarcii împreună în cadrul unui proton sau neutron. Pe o distanță mai mare, interacțiunea puternică este mai slabă. Ea este purtată de o particulă numită mezon. Mesonii atrag protonii și neutronii folosind interacțiunea puternică. Aceștia mențin nucleul laolaltă. Această formă specială a interacțiunii puternice se numește forță nucleară.
Numărul de neutroni în raport cu protonii definește dacă nucleul este stabil sau dacă suferă o dezintegrare radioactivă. Atunci când există prea mulți neutroni sau protoni, atomul încearcă să facă numerele mai mici sau mai egale prin eliminarea particulelor în plus. Acest lucru se realizează prin emiterea de radiații sub formă de dezintegrare alfa, beta sau gamma. Nucleii se pot schimba și prin alte mijloace. Fisiunea nucleară are loc atunci când nucleul se rupe în două nuclee mai mici, eliberând o cantitate mare de energie. Această eliberare de energie este ceea ce face ca fisiunea nucleară să fie utilă pentru fabricarea bombelor și a energiei electrice sub formă de energie nucleară. Celălalt mod în care nucleele se pot modifica este prin fuziunea nucleară, atunci când două nuclee se unesc sau fuzionează pentru a forma un nucleu mai mare. Acest proces necesită cantități extreme de energie pentru a depăși repulsia electrostatică dintre protoni, deoarece aceștia au aceeași sarcină. Astfel de energii ridicate sunt cel mai des întâlnite în stele precum Soarele nostru, care fuzionează hidrogenul pentru a obține combustibil. Cu toate acestea, odată ce are loc fuziunea, se eliberează mult mai multă energie datorită conversiei unei părți din masă în energie.
Electroni
Electronii orbitează sau se deplasează în jurul nucleului. Aceștia sunt numiți norul de electroni al atomului. Aceștia sunt atrași de nucleu datorită forței electromagnetice. Electronii au o sarcină negativă, iar nucleul are întotdeauna o sarcină pozitivă, așa că se atrag reciproc.
Conform modelului Bohr, unii electroni sunt mai departe de nucleu decât alții în diferite straturi. Acestea se numesc învelișuri de electroni. Am învățat că numai electronii din învelișul exterior pot realiza legături chimice. Numărul de electroni din învelișul exterior determină dacă atomul este stabil sau cu ce atomi se va lega în cadrul unei reacții chimice. Dacă un atom are doar o singură cochilie, are nevoie de doi electroni pentru a fi complet. În caz contrar, învelișul exterior are nevoie de opt electroni pentru a fi complet.
Modelul Bohr este important pentru că are ideea de niveluri de energie. Electronii din fiecare înveliș au o anumită cantitate de energie. Învelișurile care sunt mai îndepărtate de nucleu au mai multă energie. Atunci când o mică explozie de energie numită foton lovește un electron, electronul poate sări într-o cochilie cu energie mai mare. Acest foton trebuie să transporte exact cantitatea de energie potrivită pentru a aduce electronul la noul nivel energetic. Un foton este o explozie de lumină, iar cantitatea de energie determină culoarea luminii. Astfel, fiecare tip de atom va absorbi anumite culori de lumină, numite spectru de absorbție. Un electron poate, de asemenea, să trimită sau să emită un foton și să cadă într-o cochilie energetică inferioară. Din motive similare, atomul va trimite doar anumite culori de lumină, numite spectru de emisie.
Imaginea completă este mai complicată. Spre deosebire de Pământ care se mișcă în jurul Soarelui, electronii nu se deplasează în cerc. Nu putem ști care este locul exact al unui electron. Cunoaștem doar probabilitatea, sau șansa, ca acesta să se afle în orice loc. Fiecare electron face parte dintr-un orbital, care descrie locul în care este probabil să se afle. Nu se pot afla mai mult de doi electroni pe un orbital; acești doi electroni au spin diferit.
Pentru fiecare înveliș, numerotat cu 1, 2, 3 și așa mai departe, pot exista mai mulți orbitali cu forme diferite. Tipurilor de orbitali li se atribuie litere: s, p, d și f. De asemenea, pot exista mai mulți orbitali pentru o combinație de numere și litere. Pe măsură ce se adaugă mai mulți electroni, aceștia se alătură orbitalilor în ordinea de la cea mai mică la cea mai mare energie. Această ordine începe după cum urmează: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d. De exemplu, un atom de clor are 17 electroni. Astfel, acesta va avea 2 electroni în orbitalul 1s, 2 electroni în orbitalul 2s, 6 electroni în orbitalul 2p, 2 electroni în orbitalul 3s și 5 electroni în orbitalul 3p. Cu alte cuvinte, are 2 electroni în prima înveliș, 8 în a doua înveliș și 7 în a treia înveliș.
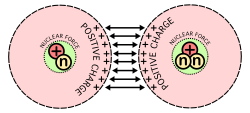
O imagine care prezintă principala dificultate în fuziunea nucleară: Protonii, care au sarcini pozitive, se resping reciproc atunci când sunt forțați să se apropie.

Forme ale diferiților orbitali din jurul unui atom
Proprietăți
Dimensiune și masă
Dimensiunea unui atom depinde de mărimea norului său de electroni. Dacă ne deplasăm în jos în tabelul periodic, se adaugă mai multe învelișuri de electroni. Ca urmare, atomii devin mai mari. Dacă ne deplasăm spre dreapta pe tabelul periodic, se adaugă mai mulți protoni la nucleu. Cu toate acestea, nu se adaugă învelișuri de electroni. Acest nucleu mai pozitiv atrage mai puternic electronii, astfel încât atomii devin mai mici. Cel mai mare atom este cesiul, care are o lățime de aproximativ 0,596 nanometri, conform unui model. Cel mai mic atom este heliul, care are o lățime de aproximativ 0,062 nanometri.
Masa atomilor este cuprinsă între 1,7×10−24 și 4,9×10 −22grame. De obicei, masa se măsoară cu ajutorul unității de masă atomică (amu), numită și dalton. Un amu reprezintă exact 1/12 din masa unui atom de carbon-12, care este de 1,7×10−24 grame. Hidrogenul-1 are o masă de aproximativ 1 amu, iar cel mai greu atom cunoscut, oganessonul, are o masă de aproximativ 294 amu.
Cum interacționează atomii
Atunci când atomii sunt foarte depărtați, se atrag reciproc. Această atracție este mai puternică pentru unele tipuri de atomi decât pentru altele. În același timp, căldura sau energia cinetică a atomilor îi face pe aceștia să se miște în mod constant. Dacă atracția este suficient de puternică, în raport cu cantitatea de căldură, atomii vor forma un solid. Dacă atracția este mai slabă, vor forma un lichid, iar dacă este și mai slabă, vor forma un gaz.
Legăturile chimice sunt cele mai puternice tipuri de atracție între atomi. Toate legăturile chimice implică mișcarea electronilor. De obicei, atomii se leagă între ei într-un mod care le umple sau golește învelișul exterior de electroni. Cele mai reactive elemente trebuie să piardă sau să câștige un număr mic de electroni pentru a avea un înveliș exterior plin. Atomii cu un înveliș exterior plin, numiți gaze nobile, nu formează de obicei legături.
Există trei tipuri principale de legături: legăturile ionice, legăturile covalente și legăturile metalice.
- Într-o legătură ionică, un atom cedează electroni unui alt atom. Fiecare atom devine un ion: un atom sau un grup de atomi cu o sarcină pozitivă sau negativă. Ionul pozitiv (care a pierdut electroni) se numește cation; acesta este de obicei un metal. Ionul negativ (care a câștigat electroni) se numește anion; este de obicei un nemetal. Legătura ionică are ca rezultat, de obicei, o rețea sau un cristal de ioni ținuți împreună.
- Într-o legătură covalentă, doi atomi își împart electronii. Acest lucru se întâmplă de obicei atunci când ambii atomi sunt nemetali. Legăturile covalente formează adesea molecule, cu dimensiuni de la doi atomi la mai mulți. De asemenea, ele pot forma rețele mari, cum ar fi sticla sau grafitul. Numărul de legături pe care le face un atom (valența sa) este, de obicei, numărul de electroni necesari pentru a umple învelișul său electronic exterior.
- Într-o legătură metalică, electronii călătoresc liber între mai mulți atomi de metal. Orice număr de atomi se pot lega în acest mod. Metalele conduc curentul electric deoarece sarcina electrică poate trece cu ușurință prin ele. Atomii din metale se pot deplasa unii pe lângă alții, astfel încât este ușor să îndoiți, să întindeți și să remodelați metalele.
Toți atomii se atrag reciproc prin forțele Van der Waals, care sunt mai slabe decât legăturile chimice. Aceste forțe sunt cauzate atunci când electronii se deplasează spre o parte a unui atom. Această mișcare conferă o sarcină negativă acelei părți. De asemenea, ea conferă o sarcină pozitivă celeilalte părți. Atunci când doi atomi își aliniază laturile cu sarcină negativă și pozitivă, aceștia se vor atrage.
În ciuda faptului că sunt în cea mai mare parte spațiu gol, atomii nu pot trece unii prin alții. Atunci când doi atomi sunt foarte apropiați, norii lor de electroni se vor respinge reciproc prin forța electromagnetică.
Magnetism
Un electron are o proprietate numită moment magnetic, care are o direcție și o mărime (sau dimensiune). Momentul magnetic provine din spinul individual al electronului și din orbita acestuia în jurul nucleului. Împreună, momentele magnetice ale electronilor se adaugă la un moment magnetic pentru întregul atom. Acest lucru explică comportamentul atomilor într-un câmp magnetic.
Fiecare electron dintr-un atom are unul dintre cele două tipuri de spin. Dacă fiecare electron este împerecheat cu un electron cu spinul opus, spinii se vor anula, astfel încât atomul nu va avea un moment magnetic de durată. Astfel de atomi se numesc diamagnetici: ei sunt doar slab respinși de un câmp magnetic.
Cu toate acestea, dacă unii electroni nu sunt împerecheați, atomul va avea un moment magnetic de durată: va fi paramagnetic sau feromagnetic. Atunci când atomii sunt paramagnetici, momentul magnetic al fiecărui atom este orientat într-o direcție aleatorie. Aceștia sunt slab atrași de un câmp magnetic. Atunci când atomii sunt feromagnetici, momentele magnetice ale atomilor apropiați acționează unul asupra celuilalt. Acestea se îndreaptă în aceeași direcție. Într-un câmp magnetic, majoritatea atomilor se vor alinia în direcția câmpului. Materialele feromagnetice, cum ar fi fierul, cobaltul și nichelul, sunt puternic atrase de un câmp magnetic.
Dezintegrarea radioactivă
Unele elemente și mulți izotopi au ceea ce se numește un nucleu instabil. Acest lucru înseamnă că nucleul este fie prea mare pentru a se menține împreună, fie are prea mulți protoni sau neutroni. Atunci când se întâmplă acest lucru, nucleul trebuie să elimine masa excesivă de particule. Acest lucru se face prin radiații. Un atom care face acest lucru poate fi numit radioactiv. Atomii instabili emit radiații până când pierd suficiente particule din nucleu pentru a deveni stabili. Toți atomii cu număr atomic mai mare de 82 (82 de protoni, plumb) sunt radioactivi.
Există trei tipuri principale de dezintegrare radioactivă: alfa, beta și gama.
- Dezintegrarea alfa are loc atunci când atomul emite o particulă cu doi protoni și doi neutroni. Acesta este, în esență, un nucleu de heliu. Rezultatul este un element cu un număr atomic cu două mai mic decât cel anterior. Astfel, de exemplu, dacă un atom de beriliu (număr atomic 4) ar trece prin dezintegrare alfa, acesta ar deveni heliu (număr atomic 2). Dezintegrarea alfa are loc atunci când un atom este prea mare și trebuie să scape de o parte din masă.
- Dezintegrarea beta are loc atunci când un neutron se transformă într-un proton sau un proton se transformă într-un neutron. În primul caz, atomul emite un electron. În cel de-al doilea caz, acesta este un pozitron (ca un electron, dar cu sarcină pozitivă). Rezultatul este un element cu un număr atomic mai mare sau mai mic cu un număr atomic decât cel anterior. Dezintegrarea beta are loc atunci când un atom are fie prea mulți protoni, fie prea mulți neutroni.
- Dezintegrarea gamma are loc atunci când un atom emite o undă sau o rază gamma. Aceasta se produce atunci când există o schimbare în energia nucleului. Acest lucru se întâmplă de obicei după ce un nucleu a trecut prin dezintegrare alfa sau beta. Nu se produce nicio schimbare în masa atomului sau în numărul atomic, ci doar în energia stocată în interiorul nucleului, sub forma spinului particulei.
Fiecare element sau izotop radioactiv are un timp de înjumătățire. Acesta este timpul necesar pentru ca jumătate din orice eșantion de atomi de acest tip să se dezintegreze până când devin un izotop sau un element diferit.
Fisiune și fuziune
Dispozitivele care utilizează fisiunea nucleară încep prin lansarea de neutroni asupra atomilor. Acest lucru face ca atomul să se spargă rapid. Prin fisiunea unui atom se lansează mai mulți neutroni, care apoi rup alți atomi, creând reacții în lanț. Acest proces generează cantități uriașe de energie termică. Reacția în lanț a fisiunii a alimentat primele arme nucleare (bombe cu fisiune). Centralele nucleare sunt puțin diferite: pentru a încetini fisiunea se folosesc niște elemente numite bare de control. Barele de control colectează o parte din neutroni, ceea ce împiedică producerea unei reacții în lanț.
Fuziunea nucleară are loc mai ales în Soare și în alte stele. Necesită un loc fierbinte, dar produce chiar mai multă energie decât fisiunea. Astfel se explică căldura și lumina Soarelui. În prezent, Soarele fuzionează hidrogenul în heliu, în timp ce stelele mai mari și mai fierbinți produc atomi mai grei. Bombele de fuziune, sau armele termonucleare, sunt cele mai puternice arme nucleare. Oamenii de știință încearcă să construiască reactoare de fuziune pentru centralele nucleare, dar încă nu există niciunul.
Fuziunea nucleară și fisiunea nucleară produc energie din motive similare. Conform celebrei formule a lui Einstein E = mc2 , o cantitate mică de masă se poate transforma într-o cantitate mare de energie. Atunci când protonii și neutronii se unesc în fuziunea nucleară, aceștia pierd o parte din masă, pe care o trimit sub formă de energie. Nucleul se poate despărți în protoni și neutroni numai dacă se adaugă aceeași cantitate de energie. Această proprietate a fiecărui tip de nucleu se numește energia de legătură nucleară. Fuziunea sau fisiunea trimit energie dacă energia totală de legătură crește. Nucleele din intervalul fier-56 și nichel-62 au cea mai mare energie de legătură împărțită la numărul lor de protoni și neutroni, astfel încât, în general, nu trec prin fisiune sau fuziune. Atomii mai mari, cum ar fi uraniul, trec prin fisiune nucleară, deoarece le crește energia de legătură.
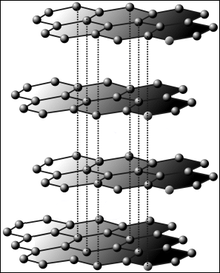
Grafitul este alcătuit din atomi de carbon în straturi. Fiecare strat este ținut împreună prin legături covalente. Atracția dintre diferitele straturi este o forță Van der Waals.
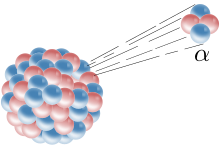
O particulă alfa este lansată dintr-un nucleu.
Formare și apariție
Aproape toți atomii de hidrogen din Univers, majoritatea atomilor de heliu și o parte din atomii de litiu au fost creați imediat după Big Bang. Chiar și astăzi, aproximativ 90% din toți atomii din Univers sunt hidrogen. Atomii mai mari sunt produși în stele prin fuziune nucleară, în timp ce cei mai mari atomi sunt produși în stelele foarte masive sau în supernove. Majoritatea atomilor de pe Pământ au fost creați de o stea care a existat înainte de Soare.
Oamenii creează atomi foarte mari prin zdrobirea unor atomi mai mici în acceleratoare de particule. Cu toate acestea, acești atomi se descompun adesea foarte repede. Oganesson (elementul 118) are un timp de înjumătățire de 0,89 milisecunde. Este posibil ca în viitor să fie creați atomi și mai mari.
Pagini conexe
- Fizica atomică, pentru mai multe detalii despre fizica atomilor
- Chimie, domeniul care studiază toate lucrurile care sunt făcute din atomi
- Particule elementare, particule care alcătuiesc atomii și orice altceva.
- Mecanica cuantică, studiul particulelor mici și al modului în care acestea interacționează cu energia
- Stări ale materiei, diferitele forme în care se pot găsi atomii sau moleculele
Întrebări și răspunsuri
Î: Ce este un atom?
R: Un atom este cea mai elementară unitate de bază a materiei. Este cea mai mică unitate de materie care se poate combina cu alți atomi pentru a forma molecule și materie mai complexă care are calități chimice specifice.
Î: Cât de mari sunt atomii?
R: Atomii sunt foarte mici, având un diametru cuprins între 0,1 și 0,5 nanometri, ceea ce înseamnă că sunt de aproximativ 100 000 de ori mai mici decât lățimea unui fir de păr uman.
Î: Care sunt cele trei tipuri de particule subatomice care alcătuiesc un atom?
R: Cele trei tipuri de particule subatomice care alcătuiesc un atom sunt protonii, neutronii și electronii. Protonii și neutronii sunt mai grei și se află în nucleu, în timp ce electronii sunt mai ușori și sunt atrași de nucleu prin forța electromagnetică datorită sarcinilor electrice opuse.
Î: Câte elemente se găsesc în mod natural în lume?
R: În lume există în mod natural aproximativ 92 de elemente.
Î: Ce se întâmplă atunci când un atom are mai mulți sau mai puțini electroni decât protoni?
R: Dacă un atom are mai mulți sau mai puțini electroni decât protoni, se numește ion și are o sarcină electrică.
Î: Ce tip de schimbări se întâmplă dacă forțele din interiorul atomilor devin prea slabe pentru a-i ține împreună?
R: Dacă forțele din interiorul atomilor devin prea slabe pentru a-i menține împreună, aceștia se pot transforma într-un alt tip de atom sau pot fi distruși complet; acest proces este studiat în fizica nucleară.
Căuta în