Oxigen | element chimic
Oxigenul este un element chimic. Are simbolul O și numărul atomic 8. Este al treilea cel mai răspândit element din univers, după hidrogen și heliu.
Oxigenul reprezintă mai mult de o cincime din volumul atmosferei Pământului. În aer, doi atomi de oxigen se unesc de obicei pentru a forma dioxigen (O
2), un gaz incolor. Acest gaz este adesea numit pur și simplu oxigen. Acesta nu are gust sau miros. Este de culoare albastru deschis atunci când este lichid sau solid.
Oxigenul face parte din grupul calcogen din tabelul periodic. Este un nemetal foarte reactiv. Formează oxizi și alți compuși cu multe elemente. Oxigenul din acești oxizi și din alți compuși (în principal minerale de silicat și carbonat de calciu în calcar) reprezintă aproape jumătate din crusta Pământului, ca masă.
Cele mai multe ființe vii folosesc oxigenul în respirație. Multe molecule din ființele vii conțin oxigen, cum ar fi proteinele, acizii nucleici, carbohidrații și grăsimile. Oxigenul face parte din apă, de care toate viețuitoarele cunoscute au nevoie pentru a trăi. Algele, cianobacteriile și plantele produc oxigenul gazos de pe Pământ prin fotosinteză. Acestea folosesc lumina Soarelui pentru a obține hidrogen din apă, eliberând oxigen.
În partea superioară a atmosferei Pământului se află ozonul (O
3), în stratul de ozon. Acesta absoarbe radiațiile ultraviolete, ceea ce înseamnă că mai puține radiații ajung la nivelul solului.
Oxigenul gazos este utilizat pentru fabricarea oțelului, a materialelor plastice și a textilelor. De asemenea, are utilizări medicale și este folosit pentru respirație atunci când nu există aer bun (de către scafandri și pompieri, de exemplu) și pentru sudură. Oxigenul lichid și compușii bogați în oxigen pot fi utilizați ca propulsoare pentru rachete.
Istoric
Oxigenul gazos (O
2) a fost izolat de Michael Sendivogius înainte de 1604. Se crede adesea că gazul a fost descoperit în 1773 de Carl Wilhelm Scheele, în Suedia, sau în 1774 de Joseph Priestley, în Anglia. Priestley este considerat de obicei principalul descoperitor, deoarece lucrarea sa a fost publicată prima (deși el l-a numit "aer deflogisticat" și nu credea că este un element chimic). Antoine Lavoisier a dat numele de oxygène gazului în 1777. El a fost prima persoană care a spus că este un element chimic. De asemenea, a avut dreptate în ceea ce privește modul în care ajută la funcționarea combustiei.
Primele experimente
Unul dintre primele experimente cunoscute privind modul în care combustia are nevoie de aer a fost realizat de grecul Philo din Bizanț în secolul al II-lea î.Hr. El a scris în lucrarea sa Pneumatica că, dacă se întoarce un vas cu susul în jos deasupra unei lumânări aprinse și se pune apă în jurul acestui vas, o parte din apă intră în vas. Philo credea că acest lucru se datorează faptului că aerul era transformat în elementul clasic foc. Acest lucru este greșit. La mult timp după aceea, Leonardo da Vinci a descoperit că o parte din aer era consumată în timpul combustiei, iar acest lucru forța apa să intre în vas.
La sfârșitul secolului al XVII-lea, Robert Boyle a descoperit că aerul este necesar pentru combustie. Chimistul englez John Mayow a completat acest lucru, demonstrând că focul are nevoie doar de o parte din aer. În prezent, numim acest lucru oxigen (O2 ). El a descoperit că o lumânare care arde într-un recipient închis face ca apa să crească până la a înlocui o paisprezecea parte din volumul de aer înainte de a se stinge. Același lucru s-a întâmplat și atunci când un șoarece viu a fost pus în cutie. De aici a dedus că oxigenul este utilizat atât pentru respirație, cât și pentru combustie.
Teoria flogistonului
Robert Hooke, Ole Borch, Mihail Lomonosov și Pierre Bayen au făcut experimente cu oxigen în secolele al XVII-lea și al XVIII-lea. Niciunul dintre ei nu a crezut că este un element chimic. Acest lucru s-a datorat probabil ideii teoriei flogistonului. Acesta era ceea ce majoritatea oamenilor credeau că provoca combustia și coroziunea.
J. J. J. Becher a venit cu această teorie în 1667, iar Georg Ernst Stahl a completat-o în 1731. Teoria flogistonului stabilea că toate materialele combustibile sunt alcătuite din două părți. O parte, numită flogiston, era degajată atunci când substanța care o conținea era arsă.
Materialele care lasă foarte puține reziduuri atunci când ard, cum ar fi lemnul sau cărbunele, erau considerate a fi alcătuite în mare parte din flogiston. Lucrurile care se corodează, cum ar fi fierul, se credea că conțin foarte puțin. Aerul nu făcea parte din această teorie.
Descoperire
Alchimistul, filozoful și medicul polonez Michael Sendivogius a scris despre ceva din aer pe care l-a numit "hrana vieții", și aceasta însemna ceea ce noi numim astăzi oxigen. Sendivogius a descoperit, între 1598 și 1604, că substanța din aer este aceeași pe care a obținut-o prin încălzirea nitratului de potasiu. Unii oameni cred că aceasta a fost descoperirea oxigenului, în timp ce alții nu sunt de acord. Unii spun că oxigenul a fost descoperit de farmacistul suedez Carl Wilhelm Scheele. Acesta a obținut oxigenul în 1771 prin încălzirea oxidului mercuric și a unor nitrați. Scheele a numit gazul "aer de foc", deoarece era singurul gaz cunoscut care permitea combustia (gazele erau numite "aeruri" la acea vreme). El și-a publicat descoperirea în 1777.
La 1 august 1774, clericul britanic Joseph Priestley a concentrat lumina solară asupra oxidului mercuric într-un tub de sticlă. În urma acestui experiment a obținut un gaz pe care l-a numit "aer deflogisticat". El a constatat că lumânările ardeau mai intens în acest gaz și că un șoarece trăia mai mult timp în timp ce îl respira. După ce a respirat gazul, Priestley a spus că se simțea ca și cum ar fi fost aerul normal, dar plămânii săi s-au simțit mai ușori și mai ușori după aceea. Descoperirile sale au fost publicate în 1775. Datorită faptului că descoperirile sale au fost publicate primele, se spune adesea că a descoperit oxigenul.
Chimistul francez Antoine Lavoisier a declarat ulterior că a descoperit și el substanța. Priestley l-a vizitat în 1774 și i-a povestit despre experimentul său. Scheele i-a trimis, de asemenea, o scrisoare lui Lavoisier în acel an, în care vorbea despre descoperirea sa.
Cercetările lui Lavoisier
Lavoisier a realizat primele experimente principale privind oxidarea. El a fost prima persoană care a explicat cum funcționează combustia. A folosit aceste experimente și alte experimente pentru a demonstra că teoria flogistonului este greșită. De asemenea, a încercat să demonstreze că substanța descoperită de Priestley și Scheele era un element chimic.
În cadrul unui experiment, Lavoisier a constatat că nu a existat nicio creștere a greutății atunci când staniul și aerul au fost încălzite într-un recipient închis. De asemenea, a constatat că aerul pătrundea înăuntru atunci când recipientul era deschis. După aceea, a constatat că greutatea staniolului a crescut cu aceeași cantitate ca și greutatea aerului care a pătruns înăuntru. Și-a publicat descoperirile în 1777. El a scris că aerul era format din două gaze. Pe unul l-a numit "aer vital" (oxigen), care este necesar pentru combustie și respirație. Pe celălalt (azotul) l-a numit "azote", care în greacă înseamnă "fără viață". (Acesta este încă numele azotului în unele limbi, inclusiv în franceză).
Lavoisier a redenumit "aerul vital" în "oxygène", de la cuvintele grecești care înseamnă "facere de acru" sau "producător de acid". L-a numit astfel deoarece credea că oxigenul se află în toți acizii, ceea ce este greșit. Mai târziu, chimiștii și-au dat seama că numele dat de Lavoiser gazului era greșit, dar numele era deja prea comun pentru a fi schimbat.
"Oxygen" a devenit denumirea în limba engleză, chiar dacă oamenii de știință englezi erau împotriva ei.
Istoria ulterioară
Teoria atomilor a lui John Dalton spunea că toate elementele au un singur atom, iar atomii din compuși sunt de obicei singuri. De exemplu, el a crezut în mod eronat că apa (H2 O) are formula doar HO. În 1805, Joseph Louis Gay-Lussac și Alexander von Humboldt au demonstrat că apa este formată din doi atomi de hidrogen și un atom de oxigen. În 1811, Amedeo Avogadro a calculat corect din ce este formată apa pe baza legii lui Avogadro.
La sfârșitul secolului al XIX-lea, oamenii de știință au descoperit că aerul poate fi transformat în lichid și că compușii din el pot fi izolați prin comprimarea și răcirea lui. Chimistul și fizicianul elvețian Raoul Pictet a descoperit oxigenul lichid prin evaporarea dioxidului de sulf pentru a transforma dioxidul de carbon în lichid. Acesta a fost apoi evaporat și el pentru a răci oxigenul gazos în vederea transformării acestuia în lichid. La 22 decembrie 1877, acesta a trimis o telegramă Academiei Franceze de Științe, în care îi anunța de descoperirea sa.

Aer de descompunere Lavoisier
Caracteristici
Proprietăți și structură moleculară
La temperatura și presiunea standard, oxigenul nu are culoare, miros sau gust. Este un gaz cu formula chimică O
2 numit dioxigen.
Ca dioxigen (sau doar oxigen gazos), doi atomi de oxigen sunt legați chimic unul de celălalt. Această legătură poate fi numită în mai multe feluri, dar pur și simplu se numește legătură dublă covalentă. Oxigenul gazos este foarte reactiv și poate reacționa cu multe alte elemente. Oxizii sunt produși atunci când elementele metalice reacționează cu oxigenul, cum ar fi oxidul de fier, cunoscut sub numele de rugină. Există o mulțime de compuși de oxid pe Pământ.
Alotropi
Alotropul (tipul) comun de oxigen de pe Pământ se numește dioxigen (O2 ). Acesta este a doua cea mai mare parte a atmosferei Pământului, după dinitrogen (N2 ). O2 are o lungime a legăturii de 121 pm și o energie de legătură de 498 kJ/mol Datorită energiei sale, O2 este utilizat de viețuitoarele complexe precum animalele.
Ozonul (O3 ) este foarte reactiv și dăunează plămânilor atunci când este inhalat. Ozonul se formează în atmosfera superioară atunci când O2 se combină cu oxigenul pur obținut atunci când O2 este divizat de radiațiile ultraviolete. Ozonul absoarbe multe radiații din partea ultravioletă a spectrului electromagnetic, astfel încât stratul de ozon din atmosfera superioară protejează Pământul de radiații.
Deasupra stratului de ozon (pe orbitele joase ale Pământului), oxigenul atomic devine cea mai comună formă.
Tetraoxigenul (O4 ) a fost descoperit în 2001. Acesta există doar în condiții extreme, atunci când se exercită o presiune mare asupra O2 .
Proprietăți fizice
Oxigenul se dizolvă mai ușor din aer în apă decât azotul. Atunci când există aceeași cantitate de aer și de apă, există o moleculă de O2 pentru fiecare 2 molecule de N2 (un raport de 1:2). Acest lucru este diferit față de aer, unde există un raport de 1:4 între oxigen și azot. De asemenea, este mai ușor pentru O2 să se dizolve în apa dulce decât în apa de mare. Oxigenul se condensează la 90,20 K (-182,95 °C, -297,31 °F) și îngheață la 54,36 K (-218,79 °C, -361,82 °F). Atât O lichid, cât și O solid2 sunt transparente, cu o culoare albastru deschis.
Oxigenul este foarte reactiv și trebuie ținut departe de orice lucru care poate arde.
Izotopi
În natură există trei izotopi stabili ai oxigenului. Aceștia sunt16 O,17 O și18 O. Aproximativ 99,7% din oxigen este reprezentat de izotopul16 O.
Ocazie
Oxigenul este al treilea cel mai răspândit element din univers, după hidrogen și heliu. Aproximativ 0,9% din masa Soarelui este oxigen.
| Cele mai comune zece elemente din galaxia Calea Lactee estimate spectroscopic | ||||
| Z | Element | Fracția de masă în părți pe milion | ||
| 1 | 739,000 | 71 × masa de oxigen (bara roșie) | ||
| 2 | 240,000 | 23 × masa de oxigen (bara roșie) | ||
| 8 | Oxigen | 10,400 |
| |
| 6 | 4,600 |
| ||
| 10 | Neon | 1,340 |
| |
În afară de fier, oxigenul este cel mai răspândit element de pe Pământ (ca masă). El reprezintă aproape jumătate (46% până la 49,2%) din scoarța terestră ca parte a compușilor de oxizi, cum ar fi dioxidul de siliciu, și a altor compuși, cum ar fi carbonații. Este, de asemenea, partea principală a oceanelor Pământului, constituind 88,8% din masă. Oxigenul gazos este a doua cea mai comună parte a atmosferei, constituind 20,95% din volumul acesteia și 23,1% din volumul său. Pământul este ciudat în comparație cu alte planete, deoarece o mare parte din atmosfera sa este formată din gaz oxigen. Marte are doar 0,1% O
2 în volum, celelalte planete având mai puțin decât atât.
Cantitatea mult mai mare de oxigen gazos din jurul Pământului este cauzată de ciclul oxigenului. Fotosinteza extrage hidrogenul din apă folosind energia de la lumina solară. Acest lucru produce oxigen gazos. O parte din hidrogen se combină cu dioxidul de carbon pentru a produce carbohidrați. Apoi, respirația preia gazul oxigen din atmosferă sau din apă și îl transformă în dioxid de carbon și apă.
Utilizează
Medical
O2 este o parte foarte importantă a respirației. Din acest motiv, este utilizat în medicină. Acesta este utilizat pentru a crește cantitatea de oxigen din sângele unei persoane, astfel încât să poată avea loc mai multă respirație. Acest lucru le poate face să se însănătoșească mai repede dacă sunt bolnave. Oxigenoterapia este folosită pentru a trata emfizemul, pneumonia, unele probleme cardiace și orice boală care face ca o persoană să aibă mai greu de asimilat oxigen.
Suport de viață
O2 de joasă presiune este utilizat în costumele spațiale, care înconjoară corpul cu acest gaz. Oxigenul pur este utilizat, dar la o presiune mult mai mică. Dacă presiunea ar fi mai mare, ar fi otrăvitor.
Industrial
Topirea minereului de fier în oțel utilizează aproximativ 55% din oxigenul produs de oameni. În acest scop, gazul O2 este injectat în minereu printr-o lance la presiune ridicată. Astfel, se elimină din minereu orice sulf sau carbon care nu ar fi dorit să se regăsească. Acestea sunt eliberate sub formă de oxid de sulf și dioxid de carbon. Temperatura poate ajunge până la 1.700 °C, deoarece este o reacție exotermă.
Aproximativ 25 % din oxigenul produs de oameni este utilizat de chimiști. Etilena reacționează cu O2 pentru a obține oxid de etilenă. Acesta este apoi transformat în etilenglicol, care este utilizat pentru a obține multe produse, cum ar fi antigelul și poliesterul (care pot fi apoi transformate în materiale plastice și țesături).
Restul de 20% din oxigenul produs de oameni este utilizat în medicină, în tăierea și sudarea metalelor, în combustibilul pentru rachete și în tratarea apei.

Un concentrator de oxigen în casa unui pacient cu emfizem
Compuși
Starea de oxidare a oxigenului este -2 în aproape fiecare compus în care se află. În câțiva compuși, starea de oxidare este -1, cum ar fi peroxizii. Compușii de oxigen cu alte stări de oxigen sunt foarte puțin frecvente.
Oxizi și alți compuși anorganici
Apă (H
2O) este un oxid de hidrogen. Este cel mai comun oxid de pe Pământ. Toate formele de viață cunoscute au nevoie de apă pentru a trăi. Apa este formată din doi atomi de hidrogen legați covalent de un atom de oxigen (oxigenul are o electronegativitate mai mare decât hidrogenul). (acesta este principiul de bază al legăturii covalente) Există, de asemenea, forțe electrostatice (forțele Van de'r Waals) între atomii de hidrogen și atomii de oxigen ai moleculelor adiacente. Aceste pseudo-legături apropie atomii cu aproximativ 15% mai mult unul de celălalt decât majoritatea celorlalte lichide simple. Acest lucru se datorează faptului că apa este o moleculă polară (distribuție asimetrică netă a electronilor) din cauza formei sale curbate, ceea ce îi conferă o direcție de câmp net globală, în principal datorită celor 2 perechi de electroni nelegate de oxigen, care împing H-urile de legătură mai departe unul de celălalt decât aranjamentul liniar cu entalpie mai mică (a se vedea CO2 ). Această proprietate este exploatată de microunde pentru a face să oscileze moleculele polare, în special apa. Și este responsabilă pentru energia suplimentară necesară pentru disocierea H2 0.
Din cauza electronegativității ridicate a oxigenului, acesta realizează legături chimice cu aproape toate celelalte elemente chimice. Aceste legături dau oxizi (de exemplu, fierul reacționează cu oxigenul pentru a da oxid de fier). Majoritatea suprafețelor metalelor se transformă în oxizi atunci când se află în aer. Suprafața fierului se va transforma în rugină (oxid de fier) atunci când se află în aer pentru o perioadă lungă de timp. Există cantități mici de dioxid de carbon (CO
2) în aer, iar acesta este transformat în carbohidrați în timpul fotosintezei. Ființele vii îl elimină în timpul respirației.
Compuși organici
Mulți compuși organici conțin oxigen. Unele dintre clasele de compuși organici care conțin oxigen sunt alcoolii, eterii, cetonele, aldehidele, acizii carboxilici, esterii și amidele. Mulți solvenți organici au, de asemenea, oxigen, cum ar fi acetona, metanolul și izopropanolul. Oxigenul se găsește, de asemenea, în aproape toate biomoleculele care sunt fabricate de ființele vii.
De asemenea, oxigenul reacționează rapid cu mulți compuși organici la temperatura camerei sau la o temperatură mai mică, atunci când are loc autoxidarea.
Producția industrială
În fiecare an, o sută de milioane de tone de O2 sunt obținute din aer pentru utilizări industriale. Industriile folosesc două metode principale pentru a produce oxigen. Cea mai comună metodă este distilarea fracționată a aerului lichefiat. N se 2evaporă, în timp ce O2 rămâne sub formă lichidă. O2 este al doilea cel mai important gaz industrial.Deoarece este mai economic , oxigenul este de obicei stocat și transportat sub formă lichidă. Un mic rezervor de oțel cu o capacitate de 16 litri de apă și o presiune de lucru de 139 bar (2015 psi) conține aproximativ 2150 de litri de gaz și cântărește 28 de kilograme (62 lb) gol. 2150 de litri de oxigen cântărește aproximativ 3 kilograme (6,6 lb).
Cealaltă metodă principală de obținere a oxigenului constă în trecerea unui flux de aer curat și uscat printr-o pereche de cernere moleculare de zeolit. Cerneala moleculară de zeolit absoarbe azotul. Astfel, se obține un flux de gaz cu o concentrație de oxigen cuprinsă între 90% și 93%.
Oxigenul gazos poate fi obținut și prin electroliza apei în oxigen molecular și hidrogen.

Cilindrul din dreapta conține oxigen lichid.
Siguranță
NFPA 704 a oxigenului spune că oxigenul gazos comprimat nu este periculos pentru sănătate și nu este inflamabil.
Toxicitate
La presiuni ridicate, oxigenul gazos (O2 ) poate fi periculos pentru animale, inclusiv pentru oameni. Acesta poate provoca convulsii și alte probleme de sănătate. Toxicitatea oxigenului începe de obicei să apară la presiuni mai mari de 50 de kilopascali (kPa), echivalentul a aproximativ 50% oxigen în aer la presiune standard (aerul de pe Pământ are aproximativ 20% oxigen).
Bebelușii prematuri obișnuiau să fie plasați în cutii cu aer cu o cantitate mare de O2 . Acest lucru a fost oprit atunci când unii bebeluși au orbit din cauza oxigenului.
Respirația de O2 pur în costumele spațiale nu provoacă daune, deoarece se folosește o presiune mai mică.
Riscuri de combustie și alte pericole
Cantitățile concentrate de O2 pur pot provoca un incendiu rapid. Atunci când oxigenul concentrat și combustibilii sunt apropiați, o ușoară aprindere poate provoca un incendiu uriaș. Echipajul Apollo 1 a fost ucis de un incendiu, deoarece aerul din capsulă avea o cantitate foarte mare de oxigen.
Dacă oxigenul lichid este vărsat pe compuși organici, cum ar fi lemnul, acesta poate exploda.
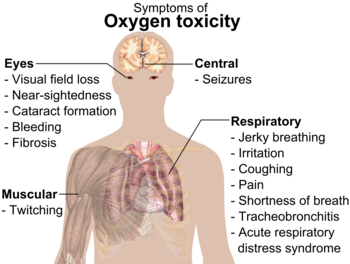
Simptomele otrăvirii cu oxigen.
Pagini conexe
Întrebări și răspunsuri
Î: Care este simbolul pentru oxigen?
R: Simbolul pentru oxigen este O.
Î: Câți atomi de oxigen se găsesc de obicei în dioxigen (O2)?
R: Dioxidul (O2) conține de obicei doi atomi de oxigen.
Î: Ce culoare are oxigenul lichid sau solid?
R: Oxigenul lichid sau solid este de culoare albastru deschis.
Î: Din ce grupă a tabelului periodic face parte oxigenul?
R: Oxigenul aparține grupului calcogen din tabelul periodic.
Î: Cât de mult din volumul atmosferei Pământului este alcătuit din oxigen?
R: Oxigenul reprezintă mai mult de o cincime din atmosfera Pământului în volum.
Î: Cum produc plantele și alte organisme cea mai mare parte din oxigenul atmosferic al Pământului?
R: Plantele și alte organisme produc cea mai mare parte din oxigenul atmosferic al Pământului prin fotosinteză, care presupune utilizarea luminii solare pentru a transforma apa în hidrogen și eliberarea de oxigen ca produs secundar.
Î: Ce utilizări are forma lichidă sau solidificată a oxigenului?
R: Formele lichide sau solidificate de oxigen pot fi utilizate ca propulsoare pentru rachete, pentru sudură, în scopuri medicale și pentru respirație atunci când nu există aer bun disponibil (de exemplu, scafandri și pompieri).
Căuta în