Mecanica cuantică | explică modul în care funcționează universul la o scară mai mică decât atomii
Mecanica cuantică explică modul în care funcționează universul la o scară mai mică decât cea a atomilor. Se mai numește și fizică cuantică sau teorie cuantică. Mecanica este partea fizicii care explică modul în care se mișcă lucrurile, iar cuantică este cuvântul latin pentru "cât de mult". Un cuantum de energie este cea mai mică cantitate posibilă (sau cea mai mică cantitate în plus), iar mecanica cuantică descrie modul în care această energie se mișcă sau interacționează.
Atomii au fost mult timp considerați cele mai mici bucăți de materie, dar știința modernă a demonstrat că există particule subatomice și mai mici, precum protonii, neutronii și electronii. Mecanica cuantică descrie modul în care funcționează particulele care alcătuiesc atomii.
Mecanica cuantică ne spune, de asemenea, cum funcționează undele electromagnetice (cum ar fi lumina). Dualitatea undă-particulă înseamnă că particulele se comportă ca niște unde, iar undele se comportă ca niște particule. (Ele nu sunt două tipuri de lucruri, ci ceva asemănător cu ambele: aceasta este dualitatea lor). O mare parte din fizica și chimia modernă poate fi descrisă și înțeleasă cu ajutorul regulilor matematice ale mecanicii cuantice.
Matematica utilizată pentru a studia particulele subatomice și undele electromagnetice este foarte complexă, deoarece acestea acționează în moduri foarte ciudate.
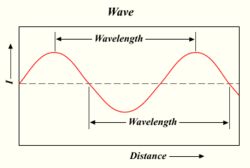
Lungimea de undă a unei unde de lumină
Undele și fotonii
Fotonii sunt particule de mărimea unui punct, mai mici decât atomii. Fotonii sunt ca niște "pachete" sau pachete de energie. Sursele de lumină, cum ar fi lumânările sau laserele, produc lumină sub formă de biți numiți fotoni.
Cu cât o lampă produce mai mulți fotoni, cu atât lumina este mai strălucitoare. Lumina este o formă de energie care se comportă la fel ca valurile din apă sau ca undele radio. Distanța dintre vârful unei unde și vârful următoarei unde se numește "lungime de undă". Fiecare foton transportă o anumită cantitate sau "cuantă" de energie, în funcție de lungimea sa de undă.
Culoarea unei lumini depinde de lungimea de undă a acesteia. Violetul (culoarea inferioară sau cea mai interioară a curcubeului) are o lungime de undă de aproximativ 400 nm ("nanometri"), adică 0,00004 centimetri sau 0,000016 inci. Fotonii cu lungimi de undă de 10-400 nm se numesc lumină ultravioletă (sau UV). O astfel de lumină nu poate fi văzută de ochiul uman. La celălalt capăt al spectrului, lumina roșie are aproximativ 700 nm. Lumina infraroșie este de aproximativ 700 nm până la 300.000 nm. Nici ochii umani nu sunt sensibili la lumina infraroșie.
Lungimile de undă nu sunt întotdeauna atât de mici. Undele radio au lungimi de undă mai mari. Lungimile de undă pentru un radio FM pot avea o lungime de câțiva metri (de exemplu, stațiile care transmit pe frecvența 99,5 FM emit energie radio cu o lungime de undă de aproximativ 3 metri, ceea ce înseamnă aproximativ 3 metri). Fiecare foton are o anumită cantitate de energie legată de lungimea sa de undă. Cu cât lungimea de undă a unui foton este mai scurtă, cu atât energia sa este mai mare. De exemplu, un foton ultraviolet are mai multă energie decât un foton infraroșu.
Lungimea de undă și frecvența (numărul de ori de câte ori unda atinge creasta pe secundă) sunt invers proporționale, ceea ce înseamnă că o lungime de undă mai mare va avea o frecvență mai mică și invers. Dacă culoarea luminii este infraroșu (cu o frecvență mai mică decât cea a luminii roșii), fiecare foton poate încălzi ceea ce atinge. Astfel, dacă o lampă cu infraroșu puternic (o lampă de căldură) este îndreptată spre o persoană, aceasta se va simți călduță sau chiar fierbinte, din cauza energiei stocate în numeroșii fotoni. Suprafața lămpii cu infraroșu se poate chiar încălzi suficient de tare pentru a arde pe cineva care ar putea să o atingă. Oamenii nu pot vedea lumina infraroșie, dar putem simți radiația sub formă de căldură. De exemplu, o persoană care trece pe lângă o clădire de cărămidă încălzită de soare va simți căldura de la clădire fără a fi nevoie să o atingă.
Ecuațiile matematice ale mecanicii cuantice sunt abstracte, ceea ce înseamnă că este imposibil să cunoaștem cu certitudine proprietățile fizice exacte ale unei particule (cum ar fi poziția sau impulsul). În schimb, o funcție matematică numită funcție de undă oferă informații despre probabilitatea cu care o particulă are o anumită proprietate. De exemplu, funcția de undă vă poate spune care este probabilitatea ca o particulă să se găsească într-o anumită locație, dar nu vă poate spune cu siguranță unde se află. Din cauza acestei incertitudini și a altor factori, nu puteți utiliza mecanica clasică (fizica care descrie modul în care se mișcă obiectele mari) pentru a prezice mișcarea particulelor cuantice.
Lumina ultravioletă are o frecvență mai mare decât cea a luminii violete, astfel încât nu se află nici măcar în gama luminii vizibile. Fiecare foton din gama ultravioletă are o cantitate mare de energie, suficientă pentru a afecta celulele pielii și a provoca arsuri solare. De fapt, cele mai multe forme de arsuri solare nu sunt cauzate de căldură; ele sunt cauzate de energia ridicată a razelor ultraviolete ale soarelui care vă afectează celulele pielii. Chiar și frecvențele mai înalte de lumină (sau radiații electromagnetice) pot pătrunde mai adânc în organism și pot provoca și mai multe daune. Razele X au atât de multă energie încât pot pătrunde adânc în corpul uman și pot ucide celulele. Oamenii nu pot vedea sau simți lumina ultravioletă sau razele X. Aceștia pot ști că au fost sub o astfel de lumină de înaltă frecvență doar atunci când suferă o arsură de radiații. Domeniile în care este important să se elimine germenii folosesc adesea lămpi cu ultraviolete pentru a distruge bacteriile, ciupercile etc. Razele X sunt uneori folosite pentru a distruge celulele canceroase.
Mecanica cuantică a început atunci când s-a descoperit că, dacă o particulă are o anumită frecvență, ea trebuie să aibă și o anumită cantitate de energie. Energia este proporțională cu frecvența (E ∝ f). Cu cât frecvența este mai mare, cu atât mai multă energie are un foton și cu atât mai multe pagube poate provoca. Mecanica cuantică a crescut ulterior pentru a explica structura internă a atomilor. Mecanica cuantică explică, de asemenea, modul în care un foton poate interfera cu el însuși și multe alte lucruri pe care fizica clasică nu și le-a imaginat niciodată.
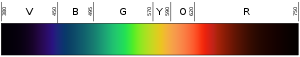
Negrul din stânga este ultraviolet (frecvență înaltă); negrul din dreapta este infraroșu (frecvență joasă).
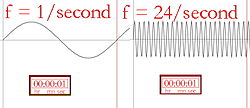
Descrierea picturală a frecvenței
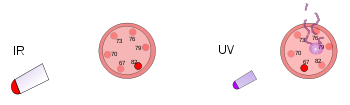
În stânga, un termometru din plastic se află sub o lampă de căldură puternică. Această radiație infraroșie încălzește termometrul, dar nu îl deteriorează. În dreapta, un alt termometru din plastic este lovit de o lumină ultravioletă de mică intensitate. Această radiație deteriorează termometrul, dar nu îl încălzește.
Cuantificare
Max Planck a descoperit relația dintre frecvență și energie. Nimeni până atunci nu bănuise că frecvența este direct proporțională cu energia (ceea ce înseamnă că, pe măsură ce una dintre ele se dublează, se dublează și cealaltă). În cadrul a ceea ce se numesc unități naturale, atunci numărul care reprezintă frecvența unui foton ar reprezenta și energia acestuia. Ecuația ar fi atunci:
ceea ce înseamnă că energia este egală cu frecvența.
Dar, în modul în care a evoluat fizica, nu a existat o legătură naturală între unitățile folosite pentru a măsura energia și unitățile folosite în mod obișnuit pentru a măsura timpul (și, prin urmare, frecvența). Astfel, formula pe care Planck a elaborat-o pentru a face ca toate cifrele să fie corecte a fost:
sau, energia este egală cu h înmulțit cu frecvența. Acest h este un număr numit constanta lui Planck, după numele descoperitorului său.
Mecanica cuantică se bazează pe cunoașterea faptului că un foton de o anumită frecvență înseamnă un foton cu o anumită cantitate de energie. Pe lângă această relație, un anumit tip de atom poate emite doar anumite frecvențe de radiație, deci poate emite doar fotoni care au o anumită cantitate de energie.
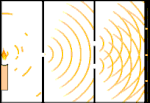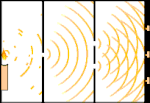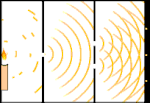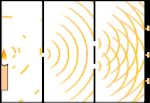
Experimentul cu două fante: lumina trece de la sursa de lumină din stânga la franjele (marcate în marginea neagră) din dreapta.
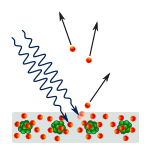
Efectul fotoelectric: fotonii lovesc metalul, iar electronii sunt împinși la distanță.
Istoric
Isaac Newton credea că lumina este formată din lucruri foarte mici, pe care noi le numim acum particule (el le numea "corpusculi"). Christiaan Huygens credea că lumina este formată din unde. Oamenii de știință credeau că un lucru nu poate fi o particulă și o undă în același timp.
Oamenii de știință au făcut experimente pentru a afla dacă lumina este formată din particule sau din unde. Ei au descoperit că ambele idei erau corecte - lumina era cumva atât unde, cât și particule. Experimentul cu fantă dublă realizat de Thomas Young a arătat că lumina trebuie să se comporte ca o undă. Efectul fotoelectric descoperit de Albert Einstein a demonstrat că lumina trebuie să se comporte ca niște particule care transportă cantități specifice de energie și că energiile sunt legate de frecvențele lor. Acest rezultat experimental se numește "dualitatea undă-particulă" în mecanica cuantică. Ulterior, fizicienii au descoperit că totul se comportă atât ca o undă, cât și ca o particulă, nu doar lumina. Cu toate acestea, acest efect este mult mai mic în cazul obiectelor mari.
Iată câteva dintre persoanele care au descoperit elementele de bază ale mecanicii cuantice: Max Planck, Albert Einstein, Satyendra Nath Bose, Niels Bohr, Louis de Broglie, Max Born, Paul Dirac, Werner Heisenberg, Wolfgang Pauli, Erwin Schrödinger, John von Neumann și Richard Feynman. Aceștia și-au desfășurat activitatea în prima jumătate a secolului XX.

De la stânga la dreapta: Max Planck, Albert Einstein, Niels Bohr, Louis de Broglie, Max Born, Paul Dirac, Werner Heisenberg, Wolfgang Pauli, Erwin Schrödinger, Richard Feynman.
Dincolo de Planck
Formulele și ideile mecanicii cuantice au fost create pentru a explica lumina care provine de la hidrogenul incandescent. De asemenea, teoria cuantică a atomului trebuia să explice de ce electronul rămâne pe orbita sa, ceea ce alte idei nu reușeau să explice. Din ideile mai vechi reieșea că electronul ar trebui să cadă în centrul atomului, deoarece la început este menținut pe orbită de propria sa energie, dar își pierde rapid energia pe măsură ce se rotește pe orbită. (Acest lucru se datorează faptului că se știa că electronii și alte particule încărcate emit lumină și pierd energie atunci când își schimbă viteza sau se rotesc).
Lămpile cu hidrogen funcționează la fel ca lămpile cu neon, dar lămpile cu neon au propriul lor grup unic de culori (și frecvențe) de lumină. Oamenii de știință au aflat că pot identifica toate elementele după culorile de lumină pe care le produc. Doar că nu și-au putut da seama cum se determină frecvențele.
Apoi, un matematician elvețian pe nume Johann Balmer a descoperit o ecuație care indica valoarea lui λ (lambda, pentru lungimea de undă):
unde B este un număr pe care Balmer l-a determinat ca fiind egal cu 364,56 nm.
Această ecuație a funcționat numai pentru lumina vizibilă emisă de o lampă cu hidrogen. Dar, mai târziu, ecuația a devenit mai generală:
unde R este constanta Rydberg, egală cu 0,0110 nm−1 , iar n trebuie să fie mai mare decât m.
Introducând numere diferite pentru m și n, este ușor de prezis frecvențele pentru multe tipuri de lumină (ultravioletă, vizibilă și infraroșie). Pentru a vedea cum funcționează acest lucru, mergeți la Hyperphysics și coborâți dincolo de mijlocul paginii. (Folosiți H = 1 pentru hidrogen).
În 1908, Walter Ritz a realizat principiul combinației Ritz, care arată cum anumite intervale între frecvențe se repetă. Acest lucru s-a dovedit a fi important pentru Werner Heisenberg câțiva ani mai târziu.
În 1905, Albert Einstein a folosit ideea lui Planck pentru a demonstra că un fascicul de lumină este alcătuit dintr-un flux de particule numite fotoni. Energia fiecărui foton depinde de frecvența sa. Ideea lui Einstein reprezintă începutul ideii din mecanica cuantică potrivit căreia toate particulele subatomice, cum ar fi electronii, protonii, neutronii și altele, sunt atât unde, cât și particule în același timp. (Vezi imaginea atomului cu electronul ca undă la atom.) Acest lucru a dus la o teorie despre particulele subatomice și undele electromagnetice numită dualitatea undă-particulă. Aceasta constă în faptul că particulele și undele nu erau nici una, nici cealaltă, ci aveau anumite proprietăți ale ambelor.
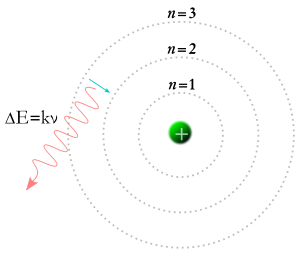
În 1913, Niels Bohr a venit cu ideea că electronii pot ocupa doar anumite orbite în jurul nucleului unui atom. Conform teoriei lui Bohr, numerele numite m și n din ecuația de mai sus ar putea reprezenta orbite. Conform teoriei lui Bohr, electronii ar putea începe pe o anumită orbită m și ar putea ajunge pe o anumită orbită n, sau un electron ar putea începe pe o anumită orbită n și ar putea ajunge pe o anumită orbită m, astfel încât, dacă un foton lovește un electron, energia acestuia va fi absorbită, iar electronul se va deplasa pe o orbită superioară datorită energiei suplimentare. Conform teoriei lui Bohr, dacă un electron cade de pe o orbită superioară pe o orbită inferioară, atunci va trebui să cedeze energie sub forma unui foton. Energia fotonului va fi egală cu diferența de energie dintre cele două orbite, iar energia unui foton îl face să aibă o anumită frecvență și culoare. Teoria lui Bohr a oferit o explicație bună pentru multe aspecte ale fenomenelor subatomice, dar nu a reușit să răspundă de ce fiecare dintre culorile luminii produse de hidrogenul incandescent (și de neon sau de orice alt element incandescent) are o luminozitate proprie, iar diferențele de luminozitate sunt întotdeauna aceleași pentru fiecare element.

În momentul în care Niels Bohr a prezentat teoria sa, se cunoșteau cele mai multe lucruri despre lumina produsă de o lampă cu hidrogen, dar oamenii de știință încă nu puteau explica luminozitatea fiecărei linii produse de hidrogenul incandescent.
Werner Heisenberg a preluat sarcina de a explica luminozitatea sau "intensitatea" fiecărei linii. El nu a putut folosi nicio regulă simplă precum cea pe care o inventase Balmer. El a trebuit să folosească matematica foarte dificilă a fizicii clasice care calculează totul în termeni de lucruri precum masa (greutatea) unui electron, sarcina (puterea electrică statică) a unui electron și alte cantități minuscule. Fizica clasică avea deja răspunsuri pentru luminozitatea benzilor de culoare pe care le produce o lampă cu hidrogen, dar teoria clasică spunea că ar trebui să existe un curcubeu continuu, și nu patru benzi de culoare separate. Explicația lui Heisenberg este următoarea:
Există o lege care spune ce frecvențe de lumină va produce hidrogenul incandescent. Ea trebuie să prezică frecvențe distanțate atunci când electronii implicați se deplasează între orbite apropiate de nucleul (centrul) atomului, dar trebuie să prezică și faptul că frecvențele se vor apropia din ce în ce mai mult pe măsură ce observăm ce face electronul în deplasarea între orbite din ce în ce mai îndepărtate. De asemenea, va prezice că diferențele de intensitate dintre frecvențe se apropie din ce în ce mai mult pe măsură ce ne îndepărtăm. Acolo unde fizica clasică oferă deja răspunsurile corecte printr-un set de ecuații, noua fizică trebuie să ofere aceleași răspunsuri, dar prin ecuații diferite.
Fizica clasică folosește metodele matematice ale lui Joseph Fourier pentru a face o imagine matematică a lumii fizice, folosind colecții de curbe netede care se unesc pentru a forma o singură curbă lină care oferă, în acest caz, intensități pentru lumina de toate frecvențele de la o anumită lumină. Dar nu este corect, deoarece această curbă netedă apare doar la frecvențe mai mari. La frecvențe mai mici, există întotdeauna puncte izolate și nimic nu leagă punctele. Așadar, pentru a realiza o hartă a lumii reale, Heisenberg a trebuit să facă o mare schimbare. A trebuit să facă ceva pentru a selecta doar numerele care să corespundă cu ceea ce se vedea în natură. Uneori, oamenii spun că a "ghicit" aceste ecuații, dar el nu a făcut presupuneri oarbe. El a găsit ceea ce avea nevoie. Numerele pe care le-a calculat ar fi pus puncte pe un grafic, dar nu ar fi existat nicio linie trasată între puncte. Iar realizarea unui "grafic" format doar din puncte pentru fiecare set de calcule ar fi irosit multă hârtie și nu ar fi dus la nimic. Heisenberg a găsit o modalitate de a prezice în mod eficient intensitățile pentru diferite frecvențe și de a organiza aceste informații într-un mod util.
Folosind doar regula empirică dată mai sus, cea pe care Balmer a început-o și Rydberg a îmbunătățit-o, putem vedea cum să obținem un set de numere care l-ar ajuta pe Heisenberg să obțină tipul de imagine pe care și-o dorea:
Regula spune că, atunci când electronul se deplasează de pe o orbită pe alta, acesta câștigă sau pierde energie, în funcție de faptul că se îndepărtează sau se apropie de centru. Astfel, putem pune aceste orbite sau niveluri de energie sub formă de rubrici de-a lungul părții superioare și laterale a unei grile. Din motive istorice, cea mai joasă orbită se numește n, iar următoarea orbită se numește n - a, apoi vine n - b și așa mai departe. Este derutant faptul că s-au folosit numere negative atunci când electronii câștigau de fapt energie, dar așa stau lucrurile.
Deoarece regula lui Rydberg ne oferă frecvențe, putem folosi această regulă pentru a introduce numere în funcție de locul unde se duce electronul. Dacă electronul începe la n și sfârșește la n, atunci nu a plecat nicăieri, deci nu a câștigat energie și nici nu a pierdut energie. Așadar, frecvența este 0. Dacă electronul începe la n-a și ajunge la n, atunci a căzut de pe o orbită superioară pe o orbită inferioară. Dacă face acest lucru, atunci pierde energie, iar energia pe care o pierde apare sub forma unui foton. Fotonul are o anumită cantitate de energie, e, iar aceasta este legată de o anumită frecvență f prin ecuația e = h f. Așadar, știm că o anumită schimbare de orbită va produce o anumită frecvență a luminii, f. Dacă electronul începe la n și ajunge la n - a, înseamnă că a trecut de pe o orbită inferioară pe o orbită superioară. Acest lucru se întâmplă numai atunci când un foton cu o anumită frecvență și energie vine din exterior, este absorbit de electron și îi conferă energie, ceea ce face ca electronul să treacă pe o orbită superioară. Așadar, pentru ca totul să aibă sens, scriem această frecvență ca număr negativ. A existat un foton cu o anumită frecvență, iar acum a fost luat.
Deci, putem face o grilă ca aceasta, unde f(a←b) înseamnă frecvența implicată atunci când un electron trece de la starea energetică (orbita) b la starea energetică a (Din nou, secvențele arată invers, dar așa au fost scrise inițial.):
Grila de f
| Stări electronice | n | n-a | n-b | n-c | .... | |
| n | f(n←n) | f(n←n-a) | f(n←n-b) | f(n←n-c) | ..... | |
| n-a | f(n-a←n) | f(n-a←n-a) | f(n-a←n-b) | f(n-a←n-c) | ..... | |
| n-b | f(n-b←n) | f(n-b←n-a) | f(n-b←n-b) | f(n-b←n-c) | ..... | |
| tranziție.... | ..... | ..... | ..... | ..... |
Heisenberg nu a făcut grilele în acest fel. El a făcut doar calculele matematice care să-i permită să obțină intensitățile pe care le căuta. Dar, pentru a face acest lucru, el a trebuit să înmulțească două amplitudini (cât de mare măsoară o undă) pentru a calcula intensitatea. (În fizica clasică, intensitatea este egală cu amplitudinea la pătrat.) A făcut o ecuație ciudată pentru a rezolva această problemă, a scris restul lucrării, i-a înmânat-o șefului său și a plecat în vacanță. Dr. Born s-a uitat la ecuația sa ciudată și i s-a părut puțin nebună. Probabil că s-a întrebat: "De ce mi-a dat Heisenberg chestia asta ciudată? De ce trebuie să o facă în felul acesta?". Apoi și-a dat seama că se uita la un plan pentru ceva ce știa deja foarte bine. El era obișnuit să numească matrice grila sau tabelul pe care îl puteam scrie făcând, de exemplu, toate calculele matematice pentru frecvențe. Iar ecuația ciudată a lui Heisenberg era o regulă pentru înmulțirea a două dintre ele. Max Born a fost un matematician foarte, foarte bun. El știa că, din moment ce cele două matrici (grile) care se înmulțesc reprezentau lucruri diferite (cum ar fi poziția (x,y,z) și impulsul (mv), de exemplu), atunci când înmulțești prima matrice cu a doua obții un răspuns, iar când înmulțești a doua matrice cu prima matrice obții un alt răspuns. Chiar dacă nu cunoștea matematica matricială, Heisenberg văzuse deja această problemă a "răspunsurilor diferite" și îl deranjase. Dar Dr. Born era un matematician atât de bun încât a văzut că diferența dintre prima înmulțire a matricei și a doua înmulțire a matricei va implica întotdeauna constanta lui Planck, h, înmulțită cu rădăcina pătrată a lui unu negativ, i. Astfel, la câteva zile după descoperirea lui Heisenberg, aveau deja matematica de bază pentru ceea ce lui Heisenberg îi plăcea să numească "principiul nedeterminării". Prin "nedeterminat", Heisenberg se referea la faptul că ceva precum un electron nu este fixat până când nu este fixat. Este un pic ca o meduză care se înghesuie mereu și nu poate fi "la un loc" decât dacă o omori. Mai târziu, oamenii au devenit obișnuiți să numească acest principiu "principiul incertitudinii lui Heisenberg", ceea ce i-a făcut pe mulți oameni să facă greșeala de a crede că electronii și alte lucruri de acest gen sunt într-adevăr "undeva", dar că noi suntem doar nesiguri în mintea noastră. Această idee este greșită. Nu despre ea vorbea Heisenberg. A avea probleme în a măsura ceva este o problemă, dar nu este problema la care se referea Heisenberg.
Ideea lui Heisenberg este foarte greu de înțeles, dar o putem face mai clară cu un exemplu. În primul rând, vom începe să numim aceste grile "matrici", deoarece în curând va trebui să vorbim despre înmulțirea matricelor.
Să presupunem că începem cu două tipuri de măsurători, poziția (q) și impulsul (p). În 1925, Heisenberg a scris o ecuație ca aceasta:

El nu știa, dar această ecuație oferă un plan pentru a scrie două matrici (grile) și pentru a le înmulți. Regulile de înmulțire a unei matrici cu alta sunt un pic dezordonate, dar iată cele două matrici conform proiectului și apoi produsul lor:
Matricea de p
| Stări electronice | n-a | n-b | n-c | .... | |
| n | p(n←n-a) | p(n←n-b) | p(n←n-c) | ..... | |
| n-a | p(n-a←n-a) | p(n-a←n-b) | p(n-a←n-c) | ..... | |
| n-b | p(n-b←n-a) | p(n-b←n-b) | p(n-b←n-c) | ..... | |
| tranziție.... | ..... | ..... | ..... | ..... |
Matricea de q
| Stări electronice | n-b | n-c | n-d | .... | |
| n-a | q(n-a←n-b) | q(n-a←n-c) | q(n-a←n-d) | ..... | |
| n-b | q(n-b←n-b) | q(n-b←n-c) | q(n-b←n-d) | ..... | |
| n-c | q(n-c←n-b) | q(n-c←n-c) | q(n-c←n-d) | ..... | |
| tranziție.... | ..... | ..... | ..... | ..... |
Matricea pentru produsul celor două matrici de mai sus, așa cum este specificată de ecuația relevantă din lucrarea lui Heisenberg din 1925, este:
| Stări electronice | n-b | n-c | n-d | ..... |
| n | A | ..... | ..... | ..... |
| n-a | ..... | B | ..... | ..... |
| n-b | ..... | ..... | C | ..... |
Unde:
A=p(n←n-a)*q(n-a←n-b)+p(n←n-b)*q(n-b←n-b)+p(n←n-c)*q(n-c←n-b)+.....
B=p(n-a←n-a)*q(n-a←n-c)+p(n-a←n-b)*q(n-b←n-c)+p(n-a←n-c)*q(n-c←n-c)+.....
C=p(n-b←n-a)*q(n-a←n-d)+p(n-b←n-b)*q(n-b←n-d)+p(n-b←n-c)*q(n-d←n-d)+.....
și așa mai departe.
Dacă matricile ar fi inversate, ar rezulta următoarele valori:
A=q(n←n-a)*p(n-a←n-b)+q(n←n-b)*p(n-b←n-b)+q(n←n-c)*p(n-c←n-b)+.....
B=q(n-a←n-a)*p(n-a←n-c)+q(n-a←n-b)*p(n-b←n-c)+q(n-a←n-c)*p(n-c←n-c)+.....
C=q(n-b←n-a)*p(n-a←n-d)+q(n-b←n-b)*p(n-b←n-d)+q(n-b←n-c)*p(n-d←n-d)+.....
și așa mai departe.
Observați cum schimbarea ordinii de înmulțire modifică, pas cu pas, numerele care sunt efectiv înmulțite.

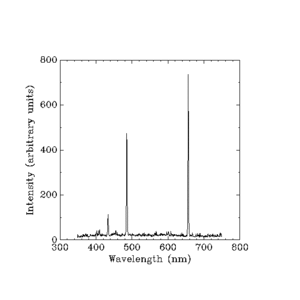
Lumina vizibilă emisă de hidrogenul incandescent. (Lungimi de undă în nanometri.)
Un electron cade pe o orbită inferioară și se creează un foton.
Intensități distanțate în unități arbitrare
Dincolo de Heisenberg
Lucrările lui Werner Heisenberg păreau să spargă un blocaj. În scurt timp, au apărut multe alte modalități diferite de a explica lucrurile, precum Louis de Broglie, Max Born, Paul Dirac, Wolfgang Pauli și Erwin Schrödinger. Munca fiecăruia dintre acești fizicieni reprezintă propria poveste. Matematica folosită de Heisenberg și de cei dintâi nu este foarte greu de înțeles, dar ecuațiile au devenit rapid foarte complicate pe măsură ce fizicienii au cercetat mai adânc lumea atomică.
Alte mistere
La începuturile mecanicii cuantice, Albert Einstein a sugerat că, dacă mecanica cuantică ar avea dreptate, ar însemna că ar exista o "acțiune ciudată la distanță". S-a dovedit că mecanica cuantică avea dreptate și că ceea ce Einstein folosise ca motiv pentru a respinge mecanica cuantică s-a întâmplat de fapt. Acest tip de "conexiune înfricoșătoare" între anumite evenimente cuantice se numește acum "încurcătură cuantică".
Atunci când un experiment aduce împreună două lucruri (fotoni, electroni etc.), acestea trebuie să aibă o descriere comună în mecanica cuantică. Atunci când sunt separate ulterior, ele își păstrează aceeași descriere sau "stare" mecanică cuantică. În diagramă, o caracteristică (de exemplu, spinul "sus") este desenată cu roșu, iar perechea sa (de exemplu, spinul "jos") este desenată cu albastru. Banda mov înseamnă că atunci când, de exemplu, doi electroni sunt puși împreună, perechea împarte ambele caracteristici. Astfel, ambii electroni ar putea prezenta fie spin ascendent, fie spin descendent. Atunci când sunt separați ulterior, unul rămânând pe Pământ și celălalt mergând pe o planetă a stelei Alpha Centauri, fiecare dintre ei continuă să aibă ambele spini. Cu alte cuvinte, fiecare dintre ei poate "decide" să se prezinte ca un electron cu spin ascendent sau ca un electron cu spin descendent. Dar dacă mai târziu cineva îl măsoară pe celălalt, acesta trebuie să "decidă" să se arate ca având spinul opus.
Einstein a argumentat că, pe o distanță atât de mare, era o nebunie să crezi că dacă forțezi un electron să își arate spinul, atunci celălalt electron va arăta cumva o caracteristică opusă. El a spus că cei doi electroni trebuie să fi fost tot timpul cu spin-up sau spin-down, dar că mecanica cuantică nu putea prezice ce caracteristică avea fiecare electron. Faptul că nu putea prezice, putând doar să se uite la unul dintre ei cu ajutorul experimentului potrivit, însemna că mecanica cuantică nu putea explica ceva important. Prin urmare, a spus Einstein, mecanica cuantică avea o mare gaură în ea. Mecanica cuantică era incompletă.
Mai târziu, s-a dovedit că experimentele au arătat că Einstein se înșela.
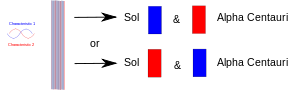
Două particule încurcate sunt separate: una pe Pământ și una pe o planetă îndepărtată. Măsurarea uneia dintre ele o obligă să "decidă" ce rol să ia, iar cealaltă trebuie să ia celălalt rol ori de câte ori (după aceea) este măsurată.
Principiul de incertitudine Heisenberg
În 1925, Werner Heisenberg a descris principiul incertitudinii, care spune că, cu cât știm mai multe despre locul în care se află o particulă, cu atât mai puțin putem ști cât de repede se deplasează și în ce direcție. Cu alte cuvinte, cu cât știm mai multe despre viteza și direcția unui obiect mic, cu atât mai puțin putem ști despre poziția sa. În astfel de discuții, fizicienii vorbesc de obicei despre impuls în loc să vorbească despre viteză. Impulsul este doar viteza unui lucru într-o anumită direcție înmulțită cu masa sa.
Principiul de incertitudine al lui Heisenberg spune că nu putem cunoaște niciodată atât locația, cât și momentul unei particule. Deoarece lumina este o particulă abundentă, ea este utilizată pentru a măsura alte particule. Singurul mod de a o măsura este de a reflecta unda de lumină asupra particulei și de a înregistra rezultatele. Dacă se utilizează un fascicul de lumină de mare energie sau de frecvență înaltă, putem spune cu precizie unde se află, dar nu putem spune cu ce viteză se deplasa. Acest lucru se datorează faptului că fotonul de înaltă energie transferă energie particulei și modifică viteza acesteia. Dacă folosim un foton de energie scăzută, putem spune cu ce viteză se deplasează, dar nu și unde se află. Acest lucru se datorează faptului că folosim lumină cu o lungime de undă mai mare. Lungimea de undă mai mare înseamnă că particula ar putea fi oriunde de-a lungul lungimii de undă.
De asemenea, principiul spune că există multe perechi de măsurători pentru care nu le putem cunoaște pe amândouă despre nicio particulă (un lucru foarte mic), indiferent cât de mult am încerca. Cu cât aflăm mai multe despre una dintre aceste perechi, cu atât mai puțin putem ști despre cealaltă.
Chiar și Albert Einstein a avut probleme în a accepta un concept atât de bizar și, într-o dezbatere bine cunoscută, a spus: "Dumnezeu nu joacă zaruri". La aceasta, fizicianul danez Niels Bohr a răspuns în mod faimos: "Einstein, nu-i spune lui Dumnezeu ce să facă".
Utilizări ale mecanicii cuantice
Electronii înconjoară nucleul fiecărui atom. Legăturile chimice leagă atomii pentru a forma molecule. O legătură chimică leagă doi atomi atunci când electronii sunt împărțiți între acești atomi. Astfel, mecanica cuantică este fizica legăturii chimice și a chimiei. Mecanica cuantică ne ajută să înțelegem cum se formează moleculele și care sunt proprietățile acestora.
Mecanica cuantică ne poate ajuta, de asemenea, să înțelegem lucruri mari, cum ar fi stelele și chiar întregul univers. Mecanica cuantică este o parte foarte importantă a teoriei despre cum a început universul, numită Big Bang.
Tot ceea ce este alcătuit din materie este atras de altă materie datorită unei forțe fundamentale numită gravitație. Teoria lui Einstein care explică gravitația se numește teoria relativității generale. O problemă în fizica modernă este că unele concluzii ale mecanicii cuantice nu par să fie în concordanță cu teoria relativității generale.
Mecanica cuantică este acea parte a fizicii care poate explica de ce toată tehnologia electronică funcționează așa cum o face. Astfel, mecanica cuantică explică modul în care funcționează calculatoarele, deoarece acestea sunt mașini electronice. Dar proiectanții primelor echipamente informatice din jurul anilor 1950 sau 1960 nu au avut nevoie să se gândească la mecanica cuantică. Nici proiectanții de radiouri și televizoare din acea perioadă nu s-au gândit la mecanica cuantică. Cu toate acestea, proiectarea circuitelor integrate mai puternice și a tehnologiilor de memorie pentru calculatoare din ultimii ani necesită mecanica cuantică.
De asemenea, mecanica cuantică a făcut posibile tehnologii precum:
De ce mecanica cuantică este greu de învățat
Mecanica cuantică este un subiect provocator din mai multe motive:
- Mecanica cuantică explică lucrurile în moduri foarte diferite de ceea ce învățăm despre lume când suntem copii.
- Înțelegerea mecanicii cuantice necesită mai multă matematică decât algebră și calcul simplu. De asemenea, este nevoie de algebră matriceală, numere complexe, teoria probabilităților și ecuații cu derivate parțiale.
- Fizicienii nu sunt siguri de ceea ce ne spun unele dintre ecuațiile mecanicii cuantice despre lumea reală.
- Mecanica cuantică sugerează că atomii și particulele subatomice se comportă în moduri ciudate, complet diferite de tot ceea ce vedem în viața noastră de zi cu zi.
- Mecanica cuantică descrie lucruri care sunt extrem de mici, astfel încât nu putem vedea unele dintre ele fără un echipament special, iar pe multe dintre ele nu le putem vedea deloc.
Mecanica cuantică descrie natura într-un mod diferit de modul în care ne gândim de obicei la știință. Ea ne spune cât de probabilă este apariția unor lucruri, în loc să ne spună că acestea se vor întâmpla cu siguranță.
Un exemplu este experimentul cu două fante al lui Young. Dacă tragem un singur foton (o singură unitate de lumină) de la un laser către o foaie de film fotografic, vom vedea o singură pată de lumină pe filmul developat. Dacă punem o foaie de metal între ele și facem două fante foarte înguste în foaie, atunci când tragem mai mulți fotoni spre foaia de metal, iar aceștia trebuie să treacă prin fante, atunci vom vedea ceva remarcabil. De-a lungul întregii foi de folie developată vom vedea o serie de benzi luminoase și întunecate. Putem folosi matematica pentru a spune exact unde vor fi benzile luminoase și cât de luminoasă a fost lumina care le-a produs, adică putem spune dinainte câți fotoni vor cădea pe fiecare bandă. Dar dacă încetinim procesul și vedem unde cade fiecare foton pe ecran, nu putem spune niciodată dinainte unde va apărea următorul. Putem ști cu siguranță că este foarte probabil ca un foton să atingă banda luminoasă centrală și că este din ce în ce mai puțin probabil ca un foton să apară pe benzile din ce în ce mai îndepărtate de centru. Astfel, știm cu siguranță că benzile vor fi cele mai luminoase în centru și că vor deveni din ce în ce mai slabe la distanță. Dar nu știm niciodată cu siguranță ce foton va intra în ce bandă.
Una dintre concluziile ciudate ale teoriei mecanicii cuantice este efectul "pisicii lui Schrödinger". Anumite proprietăți ale unei particule, cum ar fi poziția, viteza de deplasare, direcția de deplasare și "spinul", nu pot fi discutate până când ceva nu le măsoară (de exemplu, un foton care ricoșează într-un electron ar fi considerat o măsurare a poziției acestuia). Înainte de măsurare, particula se află într-o "superpoziție de stări", în care proprietățile sale au mai multe valori în același timp. Schrödinger a spus că mecanica cuantică părea să spună că, dacă ceva (cum ar fi viața sau moartea unei pisici) este determinat de un eveniment cuantic, atunci starea sa ar fi determinată de starea rezultată din evenimentul cuantic, dar numai în momentul în care cineva a privit starea evenimentului cuantic. În timpul de dinainte ca starea evenimentului cuantic să fie privită, poate că "pisica vie și cea moartă (scuzați expresia) [sunt] amestecate sau mânjite în părți egale".
Constanta lui Planck redusă
Oamenii folosesc adesea simbolul 

Exemplu
Particula într-o fântână unidimensională este cel mai simplu exemplu care arată că energia unei particule poate avea doar valori specifice. Se spune că energia este "cuantificată". Puțul are o energie potențială zero în interiorul unui interval și o energie potențială infinită peste tot în afara acelui interval. Pentru cazul unidimensional în direcția 
Utilizând ecuațiile diferențiale, ne putem da seama că ψ 
sau ca

Pereții cutiei înseamnă că funcția de undă trebuie să aibă o formă specială. Funcția de undă a particulei trebuie să fie zero în orice moment în care pereții sunt infinit de înalți. La fiecare perete:
Se consideră x = 0
- sin 0 = 0, cos 0 = 1. Pentru a satisface ψ
termenul cos trebuie eliminat. Prin urmare, D = 0
Acum gândiți-vă:
- la
, ψ
- Dacă
atunci ψ
pentru toate x. Această soluție nu este utilă.
- prin urmare,
trebuie să fie adevărat, ceea ce ne dă
Putem vedea că 
Pagini conexe
- Undă electromagnetică
- Electron
- Foton
- Încrucișarea cuantică
- Calculator cuantic
- Stare cuantică
- Ecuația lui Schrödinger
Mai multe informații
- Cox, Brian; & Forshaw, Jeff (2011). The Quantum Universe: Tot ceea ce se poate întâmpla se întâmplă și se întâmplă. Allen Lane. ISBN 978-1-84614-432-5
Întrebări și răspunsuri
Î: Ce este mecanica cuantică?
R: Mecanica cuantică este o ramură a fizicii care explică modul în care funcționează universul la o scară mai mică decât cea a atomilor. Este cunoscută și sub numele de fizică cuantică sau teoria cuantică.
Î: Ce înseamnă termenul "cuantică"?
R: Termenul "cuantic" provine din latină și înseamnă "cât de mult". Un cuantum de energie este cea mai mică cantitate posibilă (sau cea mai mică cantitate în plus), iar mecanica cuantică descrie modul în care această energie se mișcă sau interacționează.
Î: Ce sunt particulele subatomice?
R: Particulele subatomice sunt particule care alcătuiesc atomii, cum ar fi protonii, neutronii și electronii. Ele sunt chiar mai mici decât atomii.
Î: Cum descrie mecanica cuantică modul în care funcționează aceste particule?
R: Mecanica cuantică oferă reguli matematice pentru studierea particulelor subatomice și a undelor electromagnetice în scopul de a înțelege comportamentul și interacțiunile dintre ele.
Î: Ce este dualitatea undă-particulă?
R: Dualitatea undă-particulă se referă la faptul că atât particulele, cât și undele se pot comporta una ca cealaltă - nu sunt două entități distincte, ci mai degrabă ceva asemănător cu ambele combinate într-un singur fenomen.
Î: Cum poate fi descrisă fizica modernă cu ajutorul mecanicii cuantice?
R: Fizica și chimia moderne pot fi explicate prin aplicarea regulilor matematice ale mecanicii cuantice.
Căuta în









