Electron | particulă subatomică
Un electron este o bucată foarte mică de materie. Simbolul său este e− , a fost descoperit de J. J.Thomson în 1897.
Electronul este o particulă subatomică. Fiecare atom este alcătuit din câțiva electroni care înconjoară nucleul atomului. Un electron poate fi, de asemenea, separat de orice atom. Se crede că este o particulă elementară, deoarece nu poate fi descompus în nimic mai mic. Sarcina sa electrică este negativă. Electronii au o masă foarte mică (greutate mică), astfel încât este nevoie de foarte puțină energie pentru a-i deplasa rapid. Ei se pot deplasa aproape cu viteza luminii, de exemplu, sub formă de particule beta și în învelișurile interne de electroni ale elementelor cu număr atomic mare.
Electronii participă la interacțiunile gravitaționale, electromagnetice și slabe. Forța electromagnetică este cea mai puternică în situații obișnuite. Electronii se resping (se îndepărtează) unul de celălalt, deoarece au aceeași sarcină electrică. Electronii sunt atrași de protoni deoarece au sarcină electrică opusă. Un electron are un câmp electric, care descrie aceste forțe. Electricitatea care alimentează televizoarele, motoarele, telefoanele mobile și multe alte lucruri este de fapt mulți electroni care se mișcă prin fire sau alți conductori.
Descriere
Electronii au cea mai mică sarcină electrică. Această sarcină electrică este egală cu cea a unui proton, dar are semnul opus. Din acest motiv, electronii sunt atrași de protonii din nucleele atomice. Această atracție face ca electronii din apropierea unui nucleu să formeze un atom. Un electron are o masă de aproximativ 1/1836 de ori mai mare decât cea a unui proton.
Un mod de a ne gândi la locația electronilor într-un atom este să ne imaginăm că aceștia orbitează la distanțe fixe față de nucleu. În acest fel, electronii dintr-un atom există într-un număr de învelișuri electronice care înconjoară nucleul central. Fiecărui înveliș de electroni i se atribuie un număr 1, 2, 3 și așa mai departe, începând cu cel mai apropiat de nucleu (cel mai interior înveliș). Fiecare înveliș poate conține până la un anumit număr maxim de electroni. Distribuția electronilor în diferitele învelișuri se numește aranjament electronic (sau formă sau formă electronică). Aranjamentul electronic poate fi prezentat prin numerotare sau printr-o diagramă electronică. (Un alt mod de a vă gândi la amplasarea electronilor este de a utiliza mecanica cuantică pentru a calcula orbitalii atomici ai acestora).
Electronul face parte dintr-un tip de particule subatomice numite leptoni. Electronul are o sarcină electrică negativă. Electronul are o altă proprietate, numită spin. Valoarea spinului său este 1/2, ceea ce îl face să fie un fermion.
În timp ce majoritatea electronilor se găsesc în atomi, alții se mișcă independent în materie sau împreună ca raze catodice în vid. În unii supraconductori, electronii se deplasează în perechi. Atunci când electronii circulă, acest flux se numește electricitate sau curent electric.
Un obiect poate fi descris ca fiind "încărcat negativ" dacă în el există mai mulți electroni decât protoni, sau "încărcat pozitiv" dacă există mai mulți protoni decât electroni. Electronii se pot muta de la un obiect la altul atunci când sunt atinși. Aceștia pot fi atrași de un alt obiect cu sarcină opusă sau pot fi respinși atunci când amândoi au aceeași sarcină. Atunci când un obiect este "împământat", electronii din obiectul încărcat se duc în pământ, făcând obiectul neutru. Aceasta este ceea ce fac paratrăsnetele (paratrăsnete).
Reacții chimice
Electronii în învelișurile lor din jurul unui atom stau la baza reacțiilor chimice. Învelișurile exterioare complete, cu maximum de electroni, sunt mai puțin reactive. Învelișurile exterioare cu mai puțini electroni decât numărul maxim de electroni sunt reactive. Numărul de electroni din atomi reprezintă baza de bază a tabelului periodic chimic.
Măsurare
Sarcina electrică poate fi măsurată direct cu ajutorul unui dispozitiv numit electrometru. Curentul electric poate fi măsurat direct cu ajutorul unui galvanometru. Măsurarea dată de un galvanometru este diferită de măsurarea dată de un electrometru. În prezent, instrumentele de laborator sunt capabile să conțină și să observe electroni individuali.
"Vederea" unui electron
În condiții de laborator, interacțiunile electronilor individuali pot fi observate cu ajutorul detectoarelor de particule, care permit măsurarea unor proprietăți specifice, cum ar fi energia, spinul și sarcina. Într-un caz, o capcană Penning a fost utilizată pentru a conține un singur electron timp de 10 luni. Momentul magnetic al electronului a fost măsurat cu o precizie de unsprezece cifre, ceea ce, în 1980, reprezenta o precizie mai mare decât pentru orice altă constantă fizică.
Primele imagini video ale distribuției de energie a unui electron au fost captate de o echipă de la Universitatea Lund din Suedia, în februarie 2008. Oamenii de știință au folosit flash-uri de lumină extrem de scurte, numite impulsuri de attosecunde, care au permis pentru prima dată observarea mișcării unui electron. De asemenea, poate fi vizualizată distribuția electronilor în materialele solide.
Antiparticule
Antiparticula electronului se numește pozitron. Acesta este identic cu electronul, dar poartă sarcini electrice și alte sarcini de semn opus. Atunci când un electron se ciocnește cu un pozitron, aceștia se pot împrăștia unul de celălalt sau se pot anihila complet, producând o pereche (sau mai mulți) de fotoni de raze gamma.
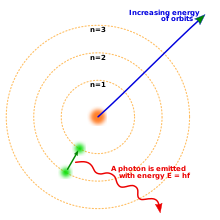
Modelul Niels Bohr al atomului. Trei învelișuri de electroni în jurul unui nucleu, cu un electron care se deplasează de la al doilea la primul nivel și eliberează un foton.
Istoria descoperirii sale
Efectele electronilor au fost cunoscute cu mult înainte de a putea fi explicate. Grecii antici știau că frecarea chihlimbarului de blană atrăgea obiectele mici. Acum știm că frecarea îndepărtează electronii, iar acest lucru conferă chihlimbarului o sarcină electrică. Mulți fizicieni au lucrat asupra electronului. J.J. Thomson a demonstrat că acesta exista în 1897, dar un alt om i-a dat numele de "electron".
Modelul norului de electroni
Modelul vede electronii ca având poziții nedeterminate într-un nor difuz în jurul nucleului atomului.
Principiul incertitudinii înseamnă că o persoană nu poate cunoaște în același timp poziția și nivelul de energie al unui electron. Aceste stări potențiale formează un nor în jurul atomului. Stările potențiale ale electronilor dintr-un singur atom formează un nor unic și uniform.
Pagini conexe
- Positron
- Proton
- Neutron
Întrebări și răspunsuri
Î: Ce este un electron?
R: Un electron este o bucată foarte mică de materie și este o particulă subatomică. Nu poate fi descompus în nimic mai mic și are o sarcină electrică negativă.
Î: Cine a descoperit electronul?
R: Electronul a fost descoperit de J.J. Thomson în 1897.
Î: Ce masă are un electron?
R: Electronii au foarte puțină masă sau greutate, astfel încât este nevoie de foarte puțină energie pentru a-i deplasa rapid.
Î: La ce tip de interacțiuni iau parte electronii?
R: Electronii participă la interacțiuni gravitaționale, electromagnetice și slabe. Forța electromagnetică este cea mai puternică în situații obișnuite.
Î: Cum interacționează electronii între ei?
R: Electronii se resping între ei deoarece au aceeași sarcină electrică, dar sunt atrași de protoni deoarece aceștia au sarcini electrice opuse.
Î: Ce alimentează televizoarele, motoarele, telefoanele mobile și multe alte lucruri?
R: Electricitatea care alimentează aceste dispozitive este de fapt mulți electroni care se mișcă prin fire sau alți conductori.
Căuta în