Vibrații moleculare
Vibrațiile moleculare sunt unul dintre cele trei tipuri diferite de mișcare pentru molecule, care includ mișcarea de translație (când întreaga moleculă merge în aceeași direcție) și mișcarea de rotație (când molecula se rotește ca un top).
Mișcarea de vibrație a unei molecule se produce atunci când legăturile dintre atomii din moleculă se mișcă. Gândiți-vă la atomi ca la niște bile rotunde care sunt atașate de un resort care se poate întinde înainte și înapoi. Un exemplu al acestei mișcări este "întinderea", cel mai simplu exemplu de vibrație pentru o moleculă și are loc între doar doi atomi. Câteva exemple de molecule care sunt de acest fel includ hidrogenul H2 , azotul N2 și oxigenul O 2
Tipuri de vibrații
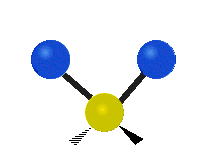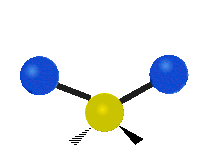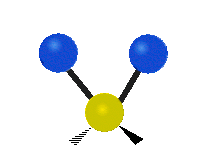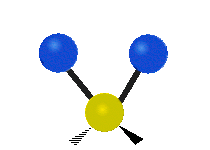
Dacă molecula are mai mult de doi atomi, atunci lucrurile se complică și mai mult. Să presupunem că se mai adaugă un singur atom, astfel încât acum există trei atomi, ca în cazul apei H2 O, unde cei doi atomi de hidrogen sunt amândoi atașați de atomul central de oxigen. Amintiți-vă că în cazul hidrogenului a existat un singur tip de întindere, dar în apă există două tipuri de întindere și alte patru tipuri de vibrații numite vibrații de încovoiere, așa cum se arată mai jos.
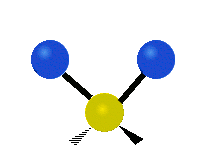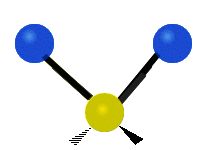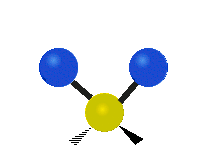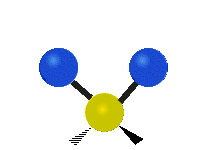
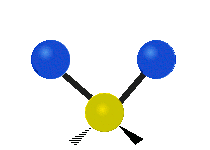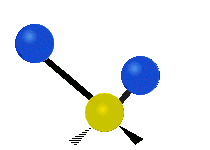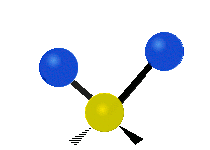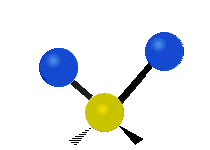
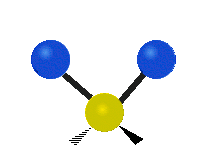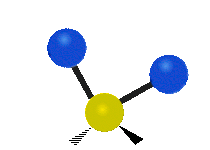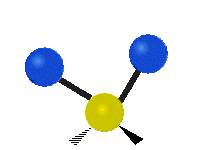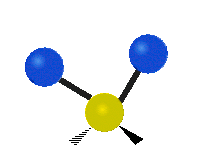
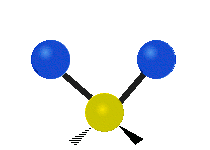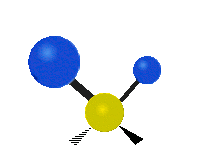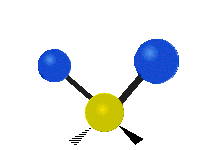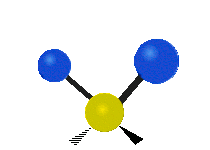
Atomii dintr-o grupare CH2 sau molecule precum apa pot vibra în șase moduri diferite: întindere simetrică și antisimetrică, foarfecă, legănare, legănare și răsucire:
| Întindere simetrică | Antisimetricăîntindere | Foarfeca |
|
|
|
|
| Leagăn | Wagging | Răsucirea |
|
|
|
|
întindere simetrică: atunci când cei doi atomi atașați se îndepărtează și se apropie de atomul central în același timp.
întindere antisimetrică: Atunci când cei doi atomi atașați nu se îndepărtează și nu se apropie de atomul central în același timp.
forfecare: Așa cum îi spune și numele, foarfeca este atunci când cei doi atomi se îndepărtează și se apropie unul de celălalt.
legănat: Această mișcare este asemănătoare cu cea a unui pendul de la un ceas care se mișcă înainte și înapoi, numai că aici pendulul este un atom și sunt doi în loc de unul.
care se mișcă: Dacă o persoană își ridică mâna în fața ei și își pune cele două degete în semnul "V" și își îndoaie încheietura mâinii spre și dinspre ea. În acest caz, vârfurile degetelor sunt atomii atașați, iar încheietura mâinii este atomul central.
răsucire: Această mișcare este ca și cum o persoană ar merge pe o bandă de alergare în care talia este atomul central și picioarele sunt cei doi atomi atașați.
Molecule cu mai mult de trei atomi
Moleculele cu mai mult de trei atomi sunt și mai complicate și au și mai multe vibrații, care sunt uneori numite "moduri de vibrație". Fiecare nou mod de vibrație este practic o combinație diferită a celor șase prezentate mai sus. Cu cât sunt mai mulți atomi în moleculă, cu atât mai multe moduri în care aceștia pot fi combinați. Pentru majoritatea moleculelor cu N atomi, numărul de vibrații posibile pentru molecula respectivă este de 3N - 6, în timp ce moleculele liniare, sau moleculele care au atomii în linie dreaptă, au 3N-5 moduri de vibrație.
Relația dintre energie și vibrații
Mecanica newtoniană
Folosind mecanica newtoniană, vibrațiile unei molecule pot fi calculate prin tratarea legăturilor ca pe niște arcuri. Acest lucru este util deoarece, la fel ca un resort, o legătură necesită energie pentru a o întinde și, de asemenea, necesită energie pentru a o strânge. Energia necesară pentru a întinde sau a strânge legătura depinde de rigiditatea legăturii, care este reprezentată de constanta elastică k, și de masa redusă sau "centrul de masă" al celor doi atomi atașați la fiecare capăt, notată cu μ. Formula utilizată pentru a relaționa energia necesară pentru a provoca o vibrație în legătură este:
E = h ν = h 2 π k μ . {\displaystyle \ E=h\nu ={h \ peste {2\pi }}{\sqrt {k \ peste \mu }}.\! }
h: este constanta lui Planck
ν: este frecvența și reprezintă rata la care legătura este strânsă și desprinsă din nou. Cu cât ν este mai mare, cu atât mai rapidă devine această rată.
Ε: este energia necesară pentru a împinge și a trage legătura.
μ: Masa de reducere este reprezentată de cele două mase ale atomilor înmulțite împreună și împărțite prin adunarea lor:
μ = m 1 m 1 m 2 m 1 + m 2 . {\displaystyle \mu ={m_{1}m_{2} \ peste m_{1}+m_{2}}.\! }
Mecanica cuantică
Folosind mecanica cuantică, formula care descrie resortul este exact aceeași cu cea din mecanica newtoniană, cu excepția faptului că sunt permise doar anumite energii sau niveluri de energie. Gândiți-vă la nivelurile de energie ca la treptele unei scări pe care o persoană nu poate urca sau coborî decât câte o treaptă pe rând. La fel cum acea persoană nu poate sta pe spațiul dintre trepte, la fel și legătura nu poate avea o energie între nivelurile de energie. Această nouă formulă devine:
E n = h ν = h ( n + 1 2 ) 1 2 π k m {\displaystyle E_{n}=h\nu =h\left(n+{1 \over 2}\right){1 \over {2\pi }}{\sqrt {k \over m}}}\! } 
unde n este un număr cuantic sau un "nivel de energie" care poate lua valori de 0, 1, 2 ... Afirmația conform căreia nivelurile de energie pot urca sau coborî doar câte un singur nivel la un moment dat este cunoscută sub numele de regulă de selecție, care afirmă că singurele tranziții permise între nivelurile de energie sunt:
Δ n = ± 1 {\displaystyle \Delta n=\pm 1}
unde \Delta n este tranziția energetică.
Aplicații ale mișcărilor vibraționale
Atunci când lumina de o anumită frecvență atinge o moleculă care are o vibrație a cărei mișcare corespunde aceleiași frecvențe, atunci lumina este absorbită de moleculă, iar energia luminii determină legăturile să se deplaseze în acea mișcare vibrațională specifică. Verificând lumina absorbită, oamenii de știință își pot da seama dacă există un anumit tip de legătură moleculară și o pot compara cu o listă de molecule care au acea legătură.
Cu toate acestea, unele molecule, cum ar fi heliul și argonul, au doar un singur atom și nu au legături. Acest lucru înseamnă că nu vor absorbi lumina în același mod în care o poate face o moleculă cu mai mult de un atom.
Domeniile specifice ale chimiei care utilizează vibrațiile moleculare în studiile lor includ spectroscopia în infraroșu (IR) și spectroscopia Raman (Raman), IR fiind cel mai larg utilizat și având trei subdomenii proprii. Aceste subdomenii sunt cunoscute sub numele de spectroscopie IR apropiat, IR mediu și IR îndepărtat. În continuare este prezentată o listă generală a acestor domenii și a aplicațiilor din lumea reală
IR apropiat: determinarea cantitativă a unor specii cum ar fi proteinele, grăsimile, hidrocarburile cu greutate moleculară mică și apa. Se obține o utilizare ulterioară în industria produselor agricole, alimentară, petrolieră și chimică
IR mediu: Cel mai popular dintre câmpurile IR, este utilizat pentru determinarea structurii compușilor organici și biochimici.
IR îndepărtat: acest domeniu este mai puțin popular, deși a găsit utilizări în studiile anorganice.
Raman: Este utilizat pentru studiul calitativ și cantitativ al sistemelor anorganice, organice și biologice, adesea ca o tehnică complementară la IR.
Căuta în