Baterie electrică
O baterie transformă energia chimică în energie electrică printr-o reacție chimică. De obicei, substanțele chimice sunt păstrate în interiorul bateriei. Aceasta este utilizată într-un circuit pentru a alimenta alte componente. O baterie produce electricitate în curent continuu (curent electric care circulă într-o singură direcție și nu se schimbă înainte și înapoi).
Utilizarea energiei electrice de la o priză dintr-o clădire este mai ieftină și mai eficientă, dar o baterie poate furniza energie electrică în zone care nu au distribuție de energie electrică. De asemenea, este utilă pentru lucrurile care se deplasează, cum ar fi vehiculele electrice și telefoanele mobile.
Bateriile pot fi primare sau secundare. Cea primară este aruncată când nu mai poate furniza energie electrică. Cea secundară poate fi reîncărcată și reutilizată.
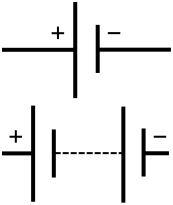
Simbolul schematic al unei baterii

Chimia din interiorul unei baterii
O baterie poate avea o singură celulă sau mai multe celule. Fiecare celulă are un anod, un catod și un electrolit. Electrolitul este principalul material din interiorul bateriei. Acesta este adesea un tip de acid și poate fi periculos la atingere. Anodul reacționează cu electrolitul pentru a produce electroni (acesta este capătul negativ sau -). Catodul reacționează cu electrolitul și preia electroni (acesta este capătul pozitiv sau +). Un curent electric se produce atunci când un fir conectează anodul la catod, iar electronii se deplasează de la un capăt la celălalt. (Dar o baterie poate fi deteriorată doar de un fir care leagă cele două capete, așa că este nevoie și de o sarcină între cele două capete. Sarcina este ceva care încetinește electronii și, de obicei, face ceva util, cum ar fi un bec într-o lanternă sau componentele electronice dintr-un calculator).Electrolitul poate fi lichid sau solid. În funcție de tipul de electrolit, o baterie se numește baterie cu celule umede sau cu celule uscate.
Reacțiile chimice care au loc într-o baterie sunt reacții exotermice. Acest tip de reacție produce căldură. De exemplu, dacă vă lăsați laptopul pornit pentru o perioadă lungă de timp și apoi atingeți bateria, aceasta va fi caldă sau fierbinte.
O baterie reîncărcabilă este reîncărcată prin inversarea reacției chimice care are loc în interiorul bateriei. Dar o baterie reîncărcabilă poate fi reîncărcată doar de un anumit număr de ori (durata de viață a reîncărcării). Chiar și bateriile încorporate nu pot fi reîncărcate la nesfârșit. În plus, de fiecare dată când o baterie este reîncărcată, capacitatea sa de a menține o sarcină scade puțin. Bateriile nereîncărcabile nu ar trebui să fie încărcate, deoarece se pot scurge diverse substanțe nocive, cum ar fi hidroxidul de potasiu.
Celulele pot fi conectate pentru a forma o baterie mai mare. Conectarea pozitivului unei celule la negativul celulei următoare se numește conectarea lor în serie. Tensiunea fiecărei baterii este adunată. Două baterii de șase volți conectate în serie vor produce 12 volți.
Conectarea pozitivă a unei celule la cea pozitivă a celeilalte și a celei negative la cea negativă se numește conectarea lor în paralel. Tensiunea rămâne aceeași, dar curentul se adună. Tensiunea este presiunea care împinge electronii prin fire, se măsoară în volți. Curentul reprezintă numărul de electroni care pot trece în același timp, se măsoară în amperi. Combinația dintre curent și tensiune reprezintă puterea (wați = volți x amperi) bateriei.
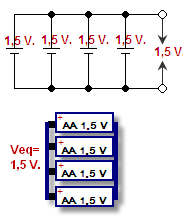
Baterii conectate în paralel - prezentate într-o schemă și un desen
Dimensiunile bateriei
Bateriile sunt disponibile în multe forme, dimensiuni și tensiuni diferite.Pilele AA, AAA, C și D, inclusiv bateriile alcaline, sunt de dimensiuni și forme standard și au aproximativ 1,5 volți. Tensiunea unei pile depinde de substanțele chimice utilizate. Sarcina electrică pe care o poate furniza depinde de cât de mare este celula, precum și de substanțele chimice. Încărcătura pe care o furnizează o baterie se măsoară de obicei în amperi-oră. Deoarece tensiunea rămâne aceeași, o sarcină mai mare înseamnă că o celulă mai mare poate furniza mai mulți amperi sau poate funcționa pentru o perioadă mai lungă de timp.
Istoric
Prima baterie a fost inventată în 1800 de Alessandro Volta. În zilele noastre, bateria sa se numește pila voltaică.În cazul bateriilor mici, moderne, fluidul este imobilizat într-un fel de pastă și totul este pus într-o carcasă sigilată. Datorită acestei carcase, nimic nu se poate vărsa din baterie. Bateriile mai mari, cum ar fi bateriile de mașină, au încă lichid în interior și nu sunt sigilate. În timpul celui de-al Doilea Război Mondial a fost inventat un tip de baterie care folosește săruri topite ca electrolit.
Tipuri de baterii
- Celule uscate, celule care nu conțin un lichid (sau care conțin un lichid imobilizat, cum ar fi o pastă sau un gel) ca electrolit.
- Celula primară, celule care nu pot fi reîncărcate
- Baterie alcalină, "alcalină", nu reîncărcabilă
- Baterie cu mercur, nu reîncărcabilă
- Baterie Leclanche, "super heavy duty", nu este reîncărcabilă
- Baterie cu litiu, nereîncărcabilă, "coin cell"
- Baterie de oxid de argint, nereîncărcabilă, baterie de ceas
- Pila voltaică, prima baterie Allesandro Voltas
- Celula secundară, celule care pot fi reîncărcate
- Baterie sigilată cu plumb-acid
- Baterie litiu-ion, reîncărcabilă, utilizată în telefoane mobile și laptopuri
- Baterie cu nichel-cadmiu, "NiCd", reîncărcabilă
- Baterie cu nichel-hidrură metalică, "NiMH", reîncărcabilă
- Baterie nichel-zinc
- Celule umede, celule care conțin lichid ca electrolit
- Baterie plumb-acid, reîncărcabilă, baterie auto
- Baterie nichel-fier, reîncărcabilă, baterie Edison
- Celula de combustibil, reîncărcată prin adăugarea de combustibil

Vedere de sus a bateriei auto
Alternative la baterii
Pilele de combustie și celulele solare nu sunt baterii, deoarece nu stochează energia în ele.Un condensator nu este o baterie, deoarece nu stochează energia dintr-o reacție chimică. Un condensator poate stoca energie electrică și poate crea energie electrică mult mai rapid decât o baterie, dar, de obicei, este prea costisitor pentru a-l face la fel de mare ca o baterie. Oamenii de știință și inginerii chimiști lucrează la fabricarea unor condensatori și baterii mai bune pentru mașinile electrice.
Micile generatoare electrice acționate cu mâna și cu piciorul pot furniza energie în dispozitive electrice mici. Radiourile cu ceas, lanternele cu ceas și alte dispozitive similare au, de asemenea, un arc de înfășurare pentru a stoca energie mecanică.
Întrebări și răspunsuri
Î: Ce este o baterie?
R: O baterie este un dispozitiv care transformă energia chimică în energie electrică printr-o reacție chimică.
Î: Cum produce o baterie energie electrică?
R: O baterie produce electricitate în curent continuu (DC), care circulă într-o singură direcție și nu se schimbă înainte și înapoi.
Î: Unde sunt păstrate substanțele chimice într-o baterie?
R: De obicei, substanțele chimice sunt păstrate în interiorul bateriei.
Î: Care este diferența dintre o baterie primară și una secundară?
R: O baterie primară este aruncată atunci când nu mai poate furniza energie electrică, în timp ce o baterie secundară poate fi reîncărcată și reutilizată.
Î: De ce sunt utile bateriile?
R: Bateriile sunt utile pentru a furniza energie electrică în zonele care nu au distribuție de energie electrică și pentru lucrurile care se deplasează, cum ar fi vehiculele electrice și telefoanele mobile.
Î: Este mai ieftină și mai eficientă utilizarea energiei electrice de la o priză dintr-o clădire decât utilizarea unei baterii?
R: Da, utilizarea energiei electrice de la o priză dintr-o clădire este mai ieftină și mai eficientă decât utilizarea unei baterii.
Î: Ce tip de electricitate produce o baterie?
R: O baterie produce electricitate de curent continuu (DC).
Căuta în