Carbocation
Un carbocation este un ion cu un atom de carbon încărcat pozitiv. Atomul de carbon încărcat dintr-un carbocation este un "sextet" (adică are doar șase electroni în învelișul său de valență exterior în loc de opt electroni de valență). Atomii de carbon cu opt alegeri de valență au stabilitatea maximă (regula octetului). Prin urmare, carbocationii sunt adesea reactivi, căutând să umple octetul de electroni de valență, precum și să redobândească o sarcină neutră. Logica ar spune că carbocationii au 3hibridizare sp cu un 3orbital sp gol care dă sarcină pozitivă. Cu toate acestea, reactivitatea unui carbocation seamănă mai mult cu hibridizarea sp2 cu o geometrie moleculară plană trigonală.
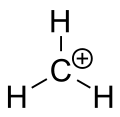
Ioni de carbeniu din metan

cation terț-butil, demonstrând o geometrie plană
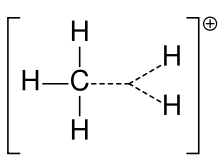
Ion de carboniu al metanului
Definiții
Anterior, un carbocation era adesea numit ion carboniu, dar chimiștii pun la îndoială semnificația exactă. În chimia actuală, un carbocation este orice atom de carbon încărcat pozitiv. Au fost sugerate două tipuri speciale: ionii de carbeniu sunt trivalenți, iar ionii de carboniu sunt pentavalenți sau hexavalenți. Manualele de nivel universitar discută despre carbocationi doar ca și cum ar fi vorba de ioni de carbeniu sau discută despre carbocationi cu o referire fugară la fraza mai veche de ioni de carboniu sau carbeniu și ioni de carboniu. Un manual școlar rămâne până în prezent cu denumirea mai veche de ion carboniu pentru ionul carbeniu și rezervă expresia de ion carbeniu hipervalent pentru CH5+.
Istoric
În 1891, G. Merling a raportat că a adăugat brom la tropiliden (cicloheptatriena) și apoi a încălzit produsul pentru a obține un material cristalin, solubil în apă, C
7H
7Br. El nu a sugerat o structură pentru aceasta; cu toate acestea, Doering și Knox au demonstrat în mod convingător că este vorba de bromură de tropiliu (cicloheptatrienil). Acest ion este prezis a fi aromatic prin regula lui Hückel.
În 1902, Norris și Kehrman au descoperit, în mod independent, că trifenilmetanolul incolor dădea soluții de culoare galben închis în acid sulfuric concentrat. Clorura de trifenilmetil a format în mod similar complecși portocalii cu cloruri de aluminiu și de staniu. În 1902, Adolf von Baeyer a recunoscut caracterul de sare al compușilor formați.

El a numit relația dintre culoare și formarea sării halochromie, dintre care verdele de malachit este un exemplu de primă mână.
Carbocationii sunt intermediari reactivi în multe reacții organice. Această idee, propusă pentru prima dată de Julius Stieglitz în 1899, a fost dezvoltată în continuare de Hans Meerwein în studiul său din 1922 privind rearanjarea Wagner-Meerwein. De asemenea, s-a constatat că carbocationii sunt implicați în reacția NS1, în reacția E1 și în reacții de rearanjare, cum ar fi trecerea 1,2 Whitmore. Instituția chimică a fost reticentă în a accepta noțiunea de carbocation și, pentru o lungă perioadă de timp, Journal of the American Chemical Society a refuzat articolele care îi menționau.
Primul spectru RMN al unui carbocation stabil în soluție a fost publicat de Doering et al. în 1958. Era vorba de ionul heptametilbenzenonium, obținut prin tratarea hexametilbenzenului cu clorură de metil și clorură de aluminiu. Cationul 7-norbornadienil stabil a fost preparat de Story et al. în 1960 prin reacția clorurii de norbornadienil cu tetrafluoroborat de argint în dioxid de sulf la -80 °C. Spectrul RMN a stabilit că acesta a fost un ion cu punte neclasică (primul ion neclasic stabil observat).
În 1962, Olah a observat direct carbocationul de terț-butil prin rezonanță magnetică nucleară ca specie stabilă la dizolvarea fluorurii de terț-butil în acid magic. Rezonanța magnetică nucleară nucleară a cationului norbornil a fost raportată pentru prima dată de Schleyer și colab. și s-a demonstrat că acesta suferă o zdruncinare de protoni peste o barieră de către Saunders și colab.
Proprietăți
În chimia organică, un carbocation este adesea ținta atacului nucleofilic al unor nucleofili precum ionii de hidroxil (OH−) sau ionii de halogen.
Carbocationii sunt clasificați ca primari, secundari sau terțiari în funcție de numărul de atomi de carbon legați de carbonul ionizat. Carbocații primari au unul sau zero carboni legați de carbonul ionizat, carbocații secundari au doi carboni legați de carbonul ionizat, iar carbocații terțiari au trei carboni legați de carbonul ionizat.
Stabilitatea carbocationului crește odată cu numărul de grupe alchil legate de carbonul purtător de sarcină. Carbocationii terțiari sunt mai stabili (și se formează mai ușor) decât carbocationii secundari; carbocationii primari sunt foarte instabili deoarece, în timp ce carbocationii ionizați de ordin superior sunt stabilizați prin hiperconjugare, carbocationii nesubstituiți (primari) nu sunt. Prin urmare, reacții precum reacția NS1 și reacția de eliminare E1 nu au loc în mod normal dacă s-ar forma un carbocation primar. O excepție apare atunci când există o legătură dublă carbon-carbon lângă carbonul ionizat. Astfel de cationi precum cationul alil CH=CH-CH22+ și cationul6 benzil CH-CH 52+sunt mai stabili decât majoritatea celorlalți carbocationi. Moleculele care pot forma carbocationi alil sau benzil sunt deosebit de reactive.
Carbocationii suferă reacții de rearanjare de la structuri mai puțin stabile la structuri la fel de stabile sau mai stabile, cu constante de viteză de peste 10/sec9. Acest fapt complică căile de sinteză pentru mulți compuși. De exemplu, atunci când 3-pentanolul este încălzit cu HCl apos, carbocationul 3-pentil format inițial se rearanjează într-un amestec statistic de 3-pentil și 2-pentil. Acești cationi reacționează cu ionul clorură pentru a produce aproximativ 1/3 3-cloropentan și 2/3 2-cloropentan.
Unii carbocationi, cum ar fi cationul norbornil, prezintă legături mai mult sau mai puțin simetrice cu trei centre. Cationii de acest tip au fost numiți ioni neclasici. Diferența de energie dintre carbocationii "clasici" și izomerii "neclasici" este adesea foarte mică și, în general, există o energie de activare mică sau chiar deloc implicată în tranziția dintre structurile "clasice" și "neclasice". Forma "neclasică" a carbocationului de 2-butilaj este, în esență, 2-butenă cu un proton direct deasupra centrului a ceea ce ar fi dubla legătură carbon-carbon. Carbocationii "neclasici" au făcut cândva obiectul unei mari controverse. Una dintre cele mai mari contribuții ale lui George Olah la chimie a fost rezolvarea acestei controverse.
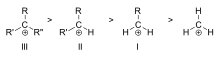
Ordinea de stabilitate a unor exemple de carbocationi alchilici terțiari (III), secundari (II) și primari (I)
Carbocationi specifici
Cationii ciclopropilcarbinilici pot fi studiați prin RMN:

În spectrul RMN al unui derivat dimetil, se găsesc două semnale neechivalente pentru cele două grupări metil, ceea ce indică faptul că conformația moleculară a acestui cation nu este perpendiculară (ca în A), ci bisectată (ca în B), cu orbitalul p gol și sistemul inelar ciclopropil în același plan:

Din punct de vedere al teoriei legăturilor curbate, această preferință se explică prin presupunerea unei suprapuneri orbitale favorabile între legăturile curbate pline ale ciclopropanului și orbitalul p gol.
Întrebări și răspunsuri
Î: Ce este un carbocation?
R: Un carbocation este un ion cu un atom de carbon încărcat pozitiv.
Î: Care este învelișul de valență exterior al unui carbocation?
R: Învelișul de valență exterior al unui carbocation are doar șase electroni în loc de opt electroni de valență stabili.
Î: De ce sunt carbocationii adesea reactivi?
R: Carbocationii sunt adesea reactivi deoarece caută să umple octetul de electroni de valență, precum și să redobândească o sarcină neutră.
Î: Care este stabilitatea maximă pentru atomii de carbon?
R: Stabilitatea maximă a atomilor de carbon este atinsă atunci când aceștia au opt electroni de valență.
Î: Ce este un sextet în chimie?
R: Un sextet este un termen utilizat pentru a descrie un atom de carbon într-un carbocation care are doar șase electroni în învelișul de valență exterior în loc de opt electroni de valență stabili.
Î: Care este hibridizarea și geometria moleculară a unui carbocation?
R: Deși logica ar sugera că carbocationii au o hibridizare sp3 cu un orbital sp3 gol care dă o sarcină pozitivă, reactivitatea lor seamănă mai mult cu o hibridizare sp2 cu o geometrie moleculară plană trigonală.
Î: Ce este regula octetului?
R: Regula octetului este un principiu în chimie care afirmă că atomii tind să formeze legături chimice cu alți atomi care permit ambilor atomi să aibă un set stabil de opt electroni de valență.
Căuta în