Nucleofil
Un nucleofil este o specie care donează o pereche de electroni unui electrofil pentru a forma o legătură chimică în cadrul unei reacții. Toate moleculele sau ionii cu o pereche de electroni liberi pot fi nucleofile. Această pereche de electroni se numește pereche solitară. Deoarece nucleofilii donează electroni, ei se încadrează în definiția bazelor Lewis.
Nucleofilic descrie atracția unui nucleofil față de nucleu. Nucleofilicitatea, denumită uneori forță nucleofilă, se referă la caracterul nucleofil al unei substanțe și este adesea utilizată pentru a compara atracția atomilor.
Reacțiile nucleofile neutre cu solvenți, cum ar fi alcoolii și apa, se numesc "solvoliză". Nucleofilii pot lua parte la reacții de substituție nucleofilă. În aceste reacții, un nucleofil devine atras de o sarcină pozitivă totală sau parțială.
Istoric
Termenii de nucleofil și electrofil au fost introduși de Christopher Kelk Ingold în 1929, înlocuind termenii de cationoid și anionoid propuși anterior de A. J. Lapworth în 1925.
Cuvântul nucleofil este derivat din nucleus și din cuvântul grecesc φιλος, philos pentru dragoste.
Proprietăți
În general, în cadrul unui rând din tabelul periodic, cu cât ionul este mai bazic (cu cât pK-ul aacidului conjugat este mai mare), cu atât este mai reactiv ca nucleofil. Într-o anumită grupă, polarizabilitatea este mai importantă în determinarea nucleofilicității. Cu alte cuvinte, cu cât este mai ușor de distorsionat norul de electroni din jurul unui atom sau al unei molecule, cu atât mai ușor va reacționa. De exemplu, ionul iodură (I−) este mai nucleofil decât ionul fluorură (F−).
Tipuri de nucleofili
Exemple de nucleofili sunt anionii, cum ar fi Cl−, sau un compus cu o pereche de electroni singuratici, cum ar fi NH3 (amoniacul).
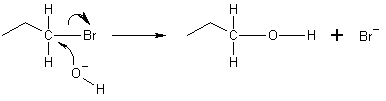
În exemplul de mai jos, oxigenul ionului de hidroxid donează o pereche de electroni pentru a se lega de carbonul de la capătul moleculei de bromopropan. Legătura dintre carbon și brom suferă apoi o fisiune heterolitică, atomul de brom luând electronul donat și devenind ionul bromură (Br−). Aceasta este o reacție NS2 care are loc prin atac pe partea din spate. Aceasta înseamnă că ionul de hidroxid atacă atomul de carbon din cealaltă parte, exact din partea opusă ionului de brom. Din cauza acestui atac pe partea din spate, reacțiile NS2 au ca rezultat o inversare a configurației electrofilului. Dacă electrofilul este chiral, acesta își păstrează de obicei chiralitatea, deși configurația produsului NS2 este inversată față de cea a electrofilului inițial (inversiunea Walden).
Un nucleofil ambident este un nucleofil care poate ataca din două sau mai multe locuri, rezultând doi sau mai mulți produși. De exemplu, ionul tiocianat (SCN−) poate ataca fie dinspre S, fie dinspre N. Din acest motiv, reacția NS2 a unei halogenuri de alchil cu SCN conduce −adesea la un amestec de RSCN (un tiocianat de alchil) și RNCS (un izotiocianat de alchil). Amestecuri similare se vor produce în sinteza nitrilului Kolbe.
Nucleofile de carbon
Halogenurile metalice de alchil sunt nucleofili de carbon care se găsesc în reacția Grignard, reacția Blaise, reacția Reformatsky și reacția Barbier, reactivi de organolițiu și anioni ai unei alchene terminale.
Enolii sunt, de asemenea, nucleofili ai carbonului. Formarea unui enol este catalizată de un acid sau de o bază. Enolii sunt nucleofili ambident, dar, în general, sunt nucleofili la atomul de carbon de lângă carbonații cu dublă legătură (atomul de carbon alfa). Enolii sunt utilizați în mod obișnuit în reacțiile de condensare, inclusiv în reacțiile de condensare Claisen și de condensare aldol.
Nucleofile de oxigen
Exemple de nucleofili de oxigen sunt apa (2HO), anionul hidroxid, alcoolii, anionii de alcoxid, peroxidul de hidrogen și anionii carboxilat.
Nucleofile de sulf
Dintre nucleofilii de sulf, cel mai des se utilizează hidrogenul sulfurat și sărurile sale, tiolii (RSH), anionii tiolatului (RS−), anionii acizilor tiolcarboxilici (RC(O)-S−) și anionii ditiocarbonaților (RO-C(S)-S−) și ai ditiocarbaților (2RN-C(S)-S). −
În general, sulful este foarte nucleofil datorită dimensiunii sale mari, care îl face ușor polarizabil, iar perechile sale de electroni solitari sunt ușor accesibile.
Nucleofile de azot
Nucleofilii de azot includ amoniacul, azidele, aminele și nitriții.
Pagini conexe
- Electrofil
- Baza Lewis
Întrebări și răspunsuri
Î: Ce este un nucleofil?
R: Un nucleofil este o specie care donează o pereche de electroni unui electrofil pentru a forma o legătură chimică în cadrul unei reacții.
Î: Ce tip de molecule sau ioni pot fi nucleofili?
R: Toate moleculele sau ionii cu o pereche de electroni liberi pot fi nucleofile.
Î: Cum se numește perechea de electroni pe care o donează nucleofilii?
R: Perechea de electroni se numește pereche solitară.
Î: În ce categorie se încadrează nucleofilii?
R: Nucleofilii se încadrează în categoria bazelor Lewis, deoarece donează electroni.
Î: Ce descrie termenul "nucleofilic"?
R: Termenul "nucleofilic" descrie atracția unui nucleofil față de nuclee.
Î: La ce se referă termenul "nucleofilicitate"?
R: Termenul "nucleofilicitate" se referă la caracterul nucleofil al unei substanțe și este adesea utilizat pentru a compara atracția atomilor.
Î: Ce sunt reacțiile de "solvoliză"?
R: Reacțiile nucleofile neutre cu solvenți, cum ar fi alcoolii și apa, se numesc "solvoliză".
Căuta în