Reacție SN2
Reacția SN 2 (cunoscută și sub numele de substituție nucleofilă bimoleculară) este o reacție de substituție în chimia organică. Este un tip de substituție nucleofilă, în care o pereche solitară de la un nucleofil atacă un centru electrofil cu deficit de electroni și se leagă de acesta. Acest lucru expulzează un alt grup numit "grup de plecare". Astfel, grupul care intră înlocuiește grupul care pleacă într-o singură etapă. Deoarece în etapa lentă a reacției, care determină viteza, sunt implicate două specii reactive, acest lucru conduce la denumirea de substituție nucleofilă bimoleculară sau SN 2. În rândul chimiștilor anorganici, reacția SN 2 este adesea cunoscută sub numele de mecanism de schimb.
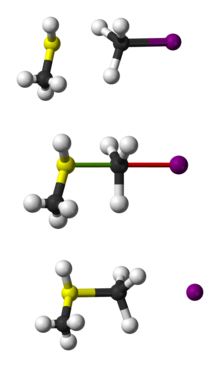
Reprezentarea cu bile și bastoane a reacției SN 2 a CH3 SH cu CH3 I
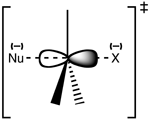
Structura stării de tranziție SN 2
Mecanismul de reacție
Reacția are loc cel mai adesea la un centru de carbon alifatice sp3 cu o grupare electronegativă, stabilă, atașată la acesta - "X" - frecvent un atom de halogenură. Ruperea legăturii C-X și formarea noii legături C-Nu au loc simultan pentru a forma o stare de tranziție în care carbonul supus atacului nucleofilic este pentacoordonat și aproximativ sp2 hibridizat. Nucleofilul atacă carbonul la 180° față de grupul de plecare, deoarece acest lucru asigură cea mai bună suprapunere între perechea singuratică a nucleofilului și orbitalul de antilegătură C-X σ*. Gruparea care pleacă este apoi împinsă de pe partea opusă și se formează produsul.
În cazul în care substratul supus atacului nucleofilic este chiral, acest lucru poate duce, deși nu neapărat, la o inversiune stereochimică, numită inversiunea Walden.
Într-un exemplu de reacție SN 2, atacul OH −(nucleofilul) asupra unui brometan (electrofilul) conduce la obținerea etanolului, cu bromură expulzată ca grup de plecare:
O reacție SN 2 are loc dacă calea de atac din spate nu este blocată de alți atomi din moleculă (împiedicată din punct de vedere steric de substituenții de pe substrat). Așadar, acest mecanism are loc de obicei la un centru de carbon primar neîmpiedicat. Dacă există o aglomerare sterică pe substrat în apropierea grupului de plecare, cum ar fi la un centru de carbon terțiar, substituția va folosi un mecanism SN 1 mai degrabă decât un mecanism SN 2, (un mecanism SN 1 ar fi, de asemenea, mai probabil în cazul moleculelor blocate, deoarece s-ar putea forma un intermediar carbocationic suficient de stabil).
În chimia de coordinare, substituția asociativă are loc printr-un mecanism similar cu cel al lui SN 2.
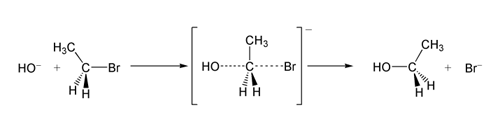
SN 2 reacția bromoetanului cu ionul hidroxid.
Factori care afectează viteza de reacție
Patru factori influențează viteza de reacție:
- Substrat. Substratul joacă cel mai important rol în determinarea vitezei reacției. Acest lucru se datorează faptului că nucleofilul atacă dinspre partea din spate a substratului, rupând astfel legătura dintre grupul de carbon și gruparea care lasă carbonul și formând legătura carbon-nucleofil. Prin urmare, pentru a maximiza viteza reacției SN 2, partea din spate a substratului trebuie să fie cât mai liberă. În general, acest lucru înseamnă că substraturile metilic și primar reacționează cel mai rapid, urmat de substraturile secundare. Substraturile terțiare nu participă la reacțiile SN 2, din cauza impedimentului steric.
- Nucleofil. Ca și în cazul substratului, impedimentul steric afectează puterea nucleofilului. Anionul metoxid, de exemplu, este atât o bază puternică, cât și un nucleofil puternic, deoarece este un nucleofil metil și, prin urmare, este foarte puțin împiedicat. Pe de altă parte, terț-butilul este o bază puternică, dar un nucleofil slab, din cauza celor trei grupări metil care îi împiedică apropierea de carbon. Puterea nucleofilă este, de asemenea, afectată de sarcină și de electronegativitate: nucleofilia crește odată cu creșterea sarcinii negative și scăderea electronegativității. De exemplu, OH- este un nucleofil mai bun decât apa, iar I- este un nucleofil mai bun decât Br- (în solvenți protici polari). Într-un solvent aprotic polar, nucleofilicitatea crește în sus pe o coloană a tabelului periodic, deoarece nu există legături de hidrogen între solvent și nucleofil. În acest caz, nucleofilicitatea reflectă bazicitatea. Prin urmare, I- ar fi un nucleofil mai slab decât Br- , deoarece este o bază mai slabă.
- Solvent. Solventul influențează viteza de reacție, deoarece solvenții pot sau nu să înconjoare un nucleofil, împiedicând sau nu apropierea acestuia de atomul de carbon. Solvenții aprotici polari, cum ar fi tetrahidrofuranul, sunt solvenți mai buni pentru această reacție decât solvenții protici polari, deoarece solvenții protici polari vor fi dizolvați de legătura de hidrogen a solventului cu nucleofilul. Acest lucru îl împiedică să atace carbonul cu gruparea de plecare.
- Plecarea grupului. Grupa care pleacă influențează viteza de reacție. Cu cât este mai stabilă grupa de plecare, cu atât este mai probabil ca aceasta să ia cei doi electroni ai legăturii de carbon cu grupa de plecare atunci când nucleofilul atacă carbonul. Prin urmare, cu cât este mai slabă ca bază conjugată, cu atât este mai bună grupa de plecare. În mod similar, cu cât este mai puternic acidul său corespunzător, cu atât este mai bună grupa de plecare. Exemple de grupe de plecare bune sunt halogenurile (cu excepția fluorurii) și tosilatul. Dar HO- și H2 N- nu sunt grupe de plecare bune.
Cinetica reacției
Viteza unei reacții SN 2 este de ordinul doi, deoarece etapa care determină viteza depinde de concentrația nucleofilului, [Nu− ], precum și de concentrația substratului, [RX].
r = k[RX][Nu− ]
Aceasta este o diferență esențială între mecanismele SN 1 și SN 2. În reacția SN 1, nucleofilul atacă după ce etapa de limitare a vitezei s-a încheiat. Dar în reacția SN 2, nucleofilul forțează eliminarea grupului de plecare în etapa de limitare. Cu alte cuvinte, viteza reacțiilor SN 1 depinde numai de concentrația substratului, în timp ce viteza reacției SN 2 depinde atât de concentrația substratului, cât și de cea a nucleofilului. În cazurile în care ambele mecanisme sunt posibile (de exemplu, la un centru de carbon secundar), mecanismul depinde de solvent, temperatură, concentrația nucleofilului sau de grupul de plecare.
Reacțiile SN 2 sunt, în general, favorizate în halogenuri de alchil primare sau halogenuri de alchil secundare cu un solvent aprotic. Acestea au loc la o rată neglijabilă în halogenurile de alchil terțiar din cauza impedimentului steric.
SN 2 și SN 1 sunt două extreme ale unei scări de reacții variabile. Este posibil să se găsească multe reacții care prezintă în mecanismele lor atât caracterul SN 2, cât și SN 1. De exemplu, este posibil să se obțină o pereche de ioni de contact formată dintr-o halogenură de alchil în care ionii nu sunt complet separați. Atunci când aceștia suferă o substituție, stereochimia va fi inversată (ca în SN 2) pentru multe dintre moleculele care reacționează, dar câteva pot prezenta păstrarea configurației. Reacțiile SN 2 sunt mai frecvente decât reacțiile SN 1.
Concurs E2
O reacție secundară frecventă care are loc în cazul reacțiilor SN 2 este eliminarea E2: anionul care intră poate acționa ca o bază și nu ca un nucleofil, eliminând un proton și conducând la formarea alchenei. Acest efect poate fi demonstrat în reacția în fază gazoasă dintre un sulfonat și o bromură de alchil simplă care are loc în interiorul unui spectrometru de masă:

În cazul bromurii de etil, produsul de reacție este predominant produsul de substituție. Pe măsură ce impedimentul steric din jurul centrului electrofilic crește, ca în cazul bromurii de izobutil, substituția este defavorizată și eliminarea este reacția predominantă. Alți factori care favorizează eliminarea sunt forța bazei. Cu substratul benzoat mai puțin bazic, bromura de izopropil reacționează cu 55% substituție. În general, reacțiile în fază gazoasă și reacțiile în fază de soluție de acest tip urmează aceleași tendințe, chiar dacă în prima se renunță la efectele solventului.
Mecanism de sens giratoriu
O evoluție care a atras atenția în 2008 se referă la un mecanism circular SN 2 observat într-o reacție în fază gazoasă între ionii de clorură și iodura de metil cu ajutorul unei tehnici speciale numite imagistică cu fascicule moleculare încrucișate. Atunci când ionii de clorură au o viteză suficientă, energia ionilor de iodură rezultați în urma coliziunii este mult mai mică decât cea așteptată, iar teoria este că energia este pierdută ca urmare a unui ocol complet al grupului metil în jurul atomului de iod înainte de a avea loc deplasarea efectivă.
Pagini conexe
- Reacție de substituție
- SN 1 reacție
Întrebări și răspunsuri
Î: Ce este reacția SN2?
R: Reacția SN2 este o reacție de substituție în chimia organică, în care un nucleofil atacă un centru electrofilic cu deficit de electroni, expulzând o grupare de plecare și apoi înlocuind-o într-o singură etapă.
Î: Ce fel de reacție de substituție este reacția SN2?
R: Reacția SN2 este un tip de reacție de substituție nucleofilă.
Î: Câte specii reactive sunt implicate în etapa lentă, care determină viteza reacției SN2?
R: Două specii reactive sunt implicate în etapa lentă, care determină viteza, a reacției SN2.
Î: Ce semnificație are denumirea de "substituție nucleofilă bimoleculară" pentru reacția SN2?
R: Denumirea de "substituție nucleofilă bimoleculară" pentru reacția SN2 se referă la faptul că două specii reactive sunt implicate în etapa lentă a reacției, care determină viteza.
Î: Ce este un nucleofil în contextul reacției SN2?
R: Un nucleofil este o moleculă sau un ion care donează o pereche solitară de electroni pentru a forma o legătură chimică.
Î: Ce este un electrofil în contextul reacției SN2?
R: Un electrofil este o moleculă sau un ion care acceptă o pereche de electroni pentru a forma o legătură chimică.
Î: Cum se numește adesea reacția SN2 în rândul chimiștilor anorganici?
R: Printre chimiștii anorganici, reacția SN2 este adesea cunoscută sub numele de mecanism de schimb.
Căuta în